Top 1000 câu hỏi thường gặp môn Hóa học có đáp án (phần 6) hay nhất được biên soạn và chọn lọc giúp bạn ôn luyện và đạt kết quả cao trong bài thi môn Hóa học.
Top 1000 câu hỏi thường gặp môn Hóa học có đáp án (phần 6)
Câu 1: Cho một bản nhôm có khối lượng 70 gam vào dung dịch CuSO4. Sau một thời gian lấy bản nhôm ra cân có khối lượng 76,9 gam. Khối lượng đồng bám vào bản nhôm là?
Lời giải:
Phản ứng xảy ra: 2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
Gọi số mol Al phản ứng là x (mol; x > 0)
→mthanh nhôm tăng = mCu – mAl
→ 64. 1,5x – 27x = 76,9 – 70 = 6,9 → x = 0,1
→ mCu = 64. 1,5x = 9,6 (gam)
Lời giải
mNa = 62 – 16 = 46 (g)
Vậy trong 1 phân tử hợp chất có 2 nguyên tử Na và 1 nguyên tử O.
Lời giải:
Vì số hạt proton = số hạt electron nên:
Gọi số hạt proton = số hạt electron = p
Số hạt nơtron = n
Ta có:
- Tổng số hạt các loại hạt trong nguyên tử phi kim X là 46 nên:
2p + n = 46 → n = 46 – 2p
Mà
→ p = 14 hoặc p = 15
Với p = 14 thì n = 46 – 28 = 18 → Z = 14 + 18 = 32 (Loại)
Với p = 15 thì n = 46 – 30 = 16 → Z = 15 + 16 = 31 (Nhận)
Vậy X là photpho (P)
- Tổng số hạt các loại hạt trong nguyên tử kim loại Y là 34 nên:
2p + n = 34 → n = 34 – 2p
Mà
→ p = 10 hoặc p = 11
Với p = 10 thì n = 34 – 20 = 14 → Z = 10 + 14 = 24 (Loại)
Với p = 11 thì n = 34 – 22 = 12 → Z = 11 + 12 = 23 (Nhận)
Vậy Y là natri (Na)
- Tổng số hạt các loại hạt trong nguyên tử khí hiếm Z là 120 nên:
2p + n = 120 → n = 120 – 2p
Mà
→ p = 35, 36, 37, 38, 39, 40
Với p = 35 thì n = 120 – 70 = 50 → Z = 35 + 50 = 85 (Loại)
Với p = 36 thì n = 120 – 72 = 48 → Z = 36 + 48 = 84 (Nhận)
Vì Z là nguyên tố khí hiếm nên các trường hợp còn lại sẽ loại hết
Vậy Z là kripton (Kr).
A. 10,79. 10-23 g;
B. 9,296. 10-23 g;
C.4,482. 10-23 g;
D. 2,656. 10-23 g.
Lời giải:
Đáp án đúng là: B
Câu 5: Nguyên tố A có tổng số hạt là 34 hạt. Tìm số hạt mỗi loại trong A, A là nguyên tố nào?
Lời giải:
Gọi: Số hạt proton = số hạt electron = p
Số hạt nơtron = n
Ta có :
2p + n = 34 ⇔ n = 34 - 2p
Mặt khác :
p ≤ n ≤ 1,5p
⇔ p ≤ 34 - 2p ≤ 1,5p
⇔ 9,7 ≤ p ≤ 11,3
Với p = 10 thì A là nguyên tố Neon suy ra n = 34 - 10.2 = 14 loại vì phân tử khối p + n = 10 + 14 = 28 ≠20
Với p = 11 thì A là nguyên tố Natri suy ra n = 34 - 11.2 = 12 chọn vì phân tử khối p + n = 11 + 12 = 23
Vậy A là natri (Na).
FexOy + H2SO4 → Fex(SO4)y + H2O
Với x ≠ y thì giá trị thích hợp của x và y lần lượt là:
A. 1 và 2;
B. 2 và 3;
C. 2 và 4;
D. 3 và 4.
Lời giải:
Đáp án đúng là: B
Fe có hóa trị II và III còn có nhóm (SO4) có hóa trị II
Mà x y → x = 2 và y = 3 là hợp lí.
Phương trình hóa học sau:
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
Lời giải:
Câu 8: Hòa tan 4,8 gam Mg vào dung dịch HCl vừa đủ thu được V lít khí H2 (ở đktc). Giá trị của V là:
A. 4,48;
B. 3,36;
C. 33,6;
Đáp án đúng là: A
→
Vậy giá trị của V là 4,48.
A. 4;
B. 3;
C. 6;
Đáp án đúng là: C
Theo giả thiết ở đây: X là este no, mạch hở có 4 nguyên tử C, tạo bởi axit và ancol.
→ X có thể là este no đơn chức, hoặc este no, hai chức
- Este no, đơn chức C4H8O2:
HCOOCH(CH3)2, HCOO(CH2)2CH3, CH3COOC2H5, C2H5COOCH3
- Este no, hai chức C4H6O4:
CH3OOC – COOCH3, HCOOCH2 – CH2OOCH.
Câu 10: Cân bằng các phương trình phản ứng và cho biết tỉ lệ số nguyên tử, phân tử:
a) Fe(OH)2 + O2 + H2O → Fe(OH)3
b) CnH2n + O2 → CO2 + H2O
c) KClO3 → KCl + O2
d) KMnO4 → K2MnO4 + MnO2 + O2
e) Fe3O4 + HCl → FeCl3 + FeCl2 + H2O
Lời giải:
a) 4Fe(OH)2 + O2 + 2H2O 4Fe(OH)3
b) 2CnH2n + 3nO2 2nCO2 + 2nH2O
c) 2KClO3 2KCl + O2
d) 2KMnO4 K2MnO4 + MnO2 + O2
e) Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
Tỉ lệ: Số phân tử Fe3O4 : Số phân tử HCl : Số phân tử FeCl3 : Số phân tử FeCl2 : Số phân tử H2O = 1 : 8 : 2 : 1 : 4
Lời giải:
Gọi x, n là số mol, hóa trị của R ( x> 0, )
Ta có PTHH: 2R + 2nHCl → 2RCln + nH2
Biện luận:
x = 1 → MR = 28 (g/mol) (Loại)
x = 2 → MR = 56 (g/mol) (Nhận)
x = 3 → MR = 84 (g/mol) (Loại)
Vậy R là sắt (Fe).
Câu 12: Phân tử khối của hợp chất Pb(NO3)2 bằng:
A. 232 đvC;
B. 271 đvC;
C. 331 đvC;
D. 180 đvC.
Lời giải:
Đáp án đúng là: C
Phân tử khối của hợp chất Pb(NO3)2 bằng: 207 + (14 + 16. 3). 2 = 331 đvC.
A. 15,76 gam;
B. 19,70 gam;
C. 9,85 gam;
D. 7,88 gam.
Lời giải:
Đáp án đúng là: C
Dung dịch X chứa ; (x mol); (y mol)
Bảo toàn điện tích: x + 2y = 0,35
Bảo toàn nguyên tố C: x + y = 0,2 + 0,1
Giải hệ: x = 0,25; y = 0,05
Nên
Lời giải:
- Trích mẫu thử, đánh số thứ tự.
- Cho các mẫu thử trên vào nước:
+ Nếu mẫu thử nào không tan là CaCO3
+ Nếu mẫu thử nào tan tạo dung dịch đục là: CaO
+ Nếu mẫu thử nào tan tạo dung dịch trong suốt là Na2O, P2O5
PTHH: Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
P2O5 + 3H2O → 2H3PO4
- Nhỏ các dung dịch trong suốt thu được vào mẫu giấy quì tím:
+ Nếu dung dịch nào làm quì tím đổi màu đỏ: H3PO4 → Chất rắn ban đầu là P2O5
+ Nếu dung dịch nào làm quì tím đổi màu xanh: NaOH → Chất rắn ban đầu là Na2O.
Câu 15: Hãy nhận biết 3 dung dịch không màu HCl, H2SO4 loãng, Na2SO4?
Lời giải:
Trích các mẫu thử và có đánh số lần lượt:
- Cho quỳ tím vào lần lượt các mẫu thử:
+ Mẫu thử làm quỳ tím hoá đỏ là HCl, H2SO4
+ Mẫu thử không làm quỳ tím chuyển màu là Na2SO4
- Cho dung dịch BaCl2 vào 2 mẫu thử làm quỳ tím hoá đỏ:
+ Dung dịch nào có kết tủa trắng là dung dịch chứa H2SO4
+ Dung dịch nào không có hiện tượng gì là HCl
PTHH: BaCl2 + H2SO4 → 2HCl + BaSO4↓
Lời giải:
Hợp chất A gồm nguyên tử nguyên tố Y liên kết với 3 nguyên tử oxi:
→ CTHH của hợp chất A là: YO3
YxO3 nặng gấp 5 lần nguyên tử oxi:
→ Y là lưu huỳnh
→ CTHH: SO3.
a) Tính phân tử khối của chất A
b) Tính nguyên tử khối của X, cho biết tên và kí hiệu của nguyên tố X
c) Chất A là đơn chất hay hợp chất? Vì sao? Viết CTHH của chất A?
Lời giải:
a) Phân tử A nặng hơn phân tử hidro 47 lần nên PTK của A bằng 47. 2. 1 = 94 (đvC)
b) Phân tử A gồm 2 nguyên tử nguyên tố X liên kết với 1 nguyên tử oxi nên A có công thức hoá học là X2O.
→ 2. NTK X + 16 = 94 → NTK X = 39 (đvC)
Vậy X là kali, kí hiệu hoá học là K.
c) Chất A là hợp chất vì được tạo nên từ 2 nguyên tố hoá học là kali và oxi.
CTHH của A là K2O.
Câu 18: Cân bằng phản ứng hoá học:
CH3CH2OH + KMnO4 + H2SO4 → CH3COOH + MnSO4 + H2O + K2SO4
Lời giải:
Chất khử: CH3CH2OH; chất oxi hoá: KMnO4.
Ta có các quá trình:
Phương trình hoá học:
5CH3CH2OH + 4KMnO4 + 6H2SO4 → 5CH3COOH + 4MnSO4 +11H2O + 2K2SO4
A. 0,2; 0,2; 0,2;
B. 0,1; 0,2; 0,1;
C. 0,2; 0,4; 0,2;
D. 0,1; 0,4; 0,1.
Lời giải:
Đáp án đúng là: C
nHCl = 0,2. 1 = 0,2 (mol); nHCl = 0,2. 1 = 0,2 (mol)
Câu 20: Nung 1kg đá vôi chứa 80% CaCO³ thu được 112 dm³ (đkct). Tính hiệu suất phân hủy đá vôi?
Lời giải:
1 kg = 1000 g
112 dm3 = 112 lít
trong đá vôi =
PTHH:
Theo PTHH:
phân huỷ = 5. 100 = 500 (g)
A. 12 đvC;
B. 14 đvC;
C. 16 đvC;
D. 52 đvC.
Lời giải:
Đáp án đúng là: C
Khí metan có phân tử gồm 1 nguyên tử C và 4 nguyên tử H nên CTHH của metan là CH4.
Phân tử khối của metan bằng 12 + 1. 4 = 16 đvC.
Câu 22: Hiện tượng hoá học khác với hiện tượng vật lý là:
A. Biến đổi về hình dạng;
B. Có sinh ra chất mới;
C. Chỉ biến đổi về trạng thái;
D. Khối lượng thay đổi.
Lời giải:
Đáp án đúng là: B
Hiện tượng hoá học khác với hiện tượng vật lý là có sinh ra chất mới.
a) Viết phương trình chữ của phản ứng trên?
b) Lập phương trình hoá học?
c) Tính khối lượng khí hiđro thu được?
Lời giải:
a) Phương trình chữ:
Kẽm + axit clohidric → Kẽm clorua + khí hiđro
b) Phương trình hoá học:
Zn + 2HCl → ZnCl2 + H2
c) Áp dụng định luật bảo toàn khối lượng, ta có:
Lời giải:
Khối lượng muối có trong 400 gam dung dịch nước muối 20% là:
Khối lượng dung dịch sau khi đổ thêm nước lã là:
Số gam nước lã cần đổ thêm là: 800 – 400 = 400 (g)
Câu 25: Tính khối lượng mol của các chất khí có tỉ khối so với khí hidro là; 16, 8, 14, 35,5, 22?
Lời giải:
A là O2
B là CH4
C là N2
D là Cl2
E là CO2
Lời giải:
FeO + H2SO4 → FeSO4 + H2O
Fe + H2SO4 → FeSO4 + H2
Hỗn hợp: Fe2O3 ( a mol); FeO (b mol)
Lời giải:
moxit =
A. 11V1 = 3V2;
B. 5V1 = 3V2;
C. V1 = V2;
D. 11V1 = 5V2.
Lời giải:
Đáp án đúng là: C
Ta có:
Phương trình:
Dung dịch thu được có pH bằng 12 nên OH- dư
pOH = 14 – pH = 14 – 12 = 2
Lời giải:
Gọi ZA, ZB lần lượt là số proton của A, B (ZA, ZB > 0)
Hợp chất X có dạng A2B5
Ta có:
Tổng số hạt proton trong phân tử là 70 → 2ZA + 5ZB = 70 (1)
Số hạt mang điện trong A nhiều hơn số hạt mang điện trong B là 14
→ 2ZA - 2ZB = 14 (2)
Giải (1), (2), ta được: ZA = 15, ZB = 8.
A. FeCl2;
B. FeCl;
C. FeCl3;
D. Fe2Cl.
Lời giải:
Đáp án đúng là: C
Trong công thức hoá học của sắt (III) oxit là Fe2O3 có sắt hoá trị III.
Trong công thức hoá học của hidro clorua là HCl có clo hoá trị I vì có 1 nguyên tử Cl liên kết với 1 nguyên tử H.
Goị CTHH đúng của sắt (III) clorua là
Áp dụng quy tắc hoá trị, ta có: III. x = I. y
Vậy CTHH đúng của sắt (III) clorua là FeCl3.
Câu 31: Trong hợp chất của lưu huỳnh, hàm lượng lưu huỳnh chiếm 50%. Hợp chất đó có công thức là:
A. SO3;
B. H2SO4;
C. CuS;
D. SO2.
Lời giải:
Đáp án đúng là: D
Hợp chất có dạng SxOy
Vậy hợp chất là SO2.
A. 0,05M;
Phương trình: Ba(OH)2 + 2HCl → BaCl2 + H2O
So sánh: → HCl dư, Ba(OH)2 phản ứng hết
Theo phương trình:
Lời giải
Phương trình: Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
Ta thấy:
nên Fe2O3 dư
A. 45,0%;
B. 47,5%;
C. 52,5%;
D. 55,0%.
Lời giải:
Đáp án đúng là: C
Giả sử trong 1 mol hỗn hợp có x mol CO và y mol CO2
Ta có hệ:
Trong cùng điều kiện tỉ lệ thể tích chính là tỉ lệ mol
A. 31,22;
B. 34,10;
C. 33,70;
D. 34,32.
Lời giải:
Đáp án đúng là: B
Gọi số mol của Mg và Zn lần lượt là x và y mol
→mhh = 24x + 65y = 8,9 (1)
Giả sử trong X chứa muối NH4NO3 (a mol)
Xét quá trình cho – nhận e:
Bảo toàn e:
trong muối = n e cho = 2x + 2y (mol)
Bảo toàn nguyên tố N:
Từ (1), (2), (3), ta được: x = 0,1; y = 0,1; a = 0,005.
→mmuối = mkim loại + trong muối +
mmuối = 8,9 + 62. (2. 0,1 + 2. 0,1) + 80. 0,005 = 34,1 (gam)
Câu 36:Hoà tan hoàn toàn m gam hỗn hợp X gồm Al và Al2O3 trong 1,37 lít dung dịch HNO3 1M thu được dung dịch Y và 0,672 lít (đktc) hỗn hợp khí Z có khối lượng 1,16 gam gồm hai khí N2O và N2. Cô cạn dung dịch Y được chất rắn T. Nung T đến khối lượng không đổi thu được (m + 2,4) gam chất rắn. Mặt khác, để tác dụng với các chất trong dung dịch Y thì cần tối đa 1,705 lít dung dịch KOH 1M. Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng của Al trong X là:
A. 16,875%;
B. 15,00%;
C. 17,49%;
D. 14,79%.
Lời giải:
Đáp án đúng là: B
Z gồm N2O (0,02) và N2 (0,01)
Để oxi hoá hoàn toàn X cần
Bảo toàn electron:
ban đầu = 1,37; nKOH = 1,705
Bảo toàn N:
Bảo toàn điện tích:
Bảo toàn Al:
a) Xác định tên kim loại M.
b) Tính giá trị của V.
Lời giải:
PTHH: MO + H2SO4 → MSO4 + H2O
Giả sử
Ta có:
Mặt khác: mdd (sau phản ứng) = mMO + = M + 2016 (g)
Vậy kim loại cần tìm là đồng (Cu).
a) Viết các PTHH xảy ra. Tính khối lượng của mỗi chất trong hỗn hợp ban đầu.
b)Tính nồng độ % của dung dịch HCl đã dùng
c) Tính nồng độ % của muối thu được trong dung dịch X.
Lời giải:
a) PTHH:
MgO + 2HCl → MgCl2 + H2O
MgCO3 + 2HCl → MgCl2 + H2O + CO2↑
b)
c)
a) Tác dụng được với dung dịch HCl?
b) Bị phân hủy ở nhiệt độ cao?
c) Tác dụng được với dung dịch FeCl3?
d) Đổi màu quỳ tím thành xanh?
e) Tác dụng được với khí CO2?
Lời giải:
a) Cu(OH)2, KOH, Fe(OH)3, NaOH, Al(OH)3, Mg(OH)2, Ba(OH)2, Zn(OH)2
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
KOH + HCl → KCl + H2O
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
NaOH + HCl → NaCl + H2O
Al(OH)3 + 3HCl → AlCl3 + 3H2O
Mg(OH)2 + 2HCl → MgCl2 + 2H2O
Ba(OH)2 + 2HCl → BaCl2 + 2H2O
Zn(OH)2 + 2HCl → ZnCl2 + 2H2O
b) Cu(OH)2, Fe(OH)3, Al(OH)3, Mg(OH)2, Zn(OH)2
c) KOH, NaOH, Ba(OH)2
d) KOH, NaOH, Ba(OH)2
e) KOH, NaOH, Ba(OH)2
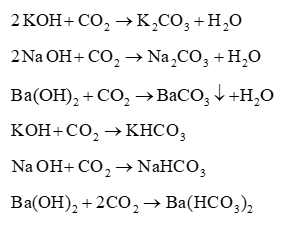
A. C;
B. Al;
C. N;
Đáp án đúng là: A
X là một hợp chất giữa A với O, trong đó A có hoá trị II nên X có CTHH là AO.
Biết rằng tổng hoá trị của A trong X và trong Y bằng 6 nên hoá trị của A trong Y là IV → CTHH của Y là AH4.
;
Tỉ số giữa thành phần phần trăm về khối lượng của A trong hợp chất Y và trong hợp chất X là 1,75 nên ta có:
A là nguyên tố cacbon (C).
Lời giải:
Đưa nam châm mạnh lại gần hỗn hợp. Sắt bị nam châm hút nên tách được bột sắt khỏi hỗn hợp.
Hoà tan hỗn hợp còn lại vào nước. Lọc dung dịch thu được cát không tan và dung dịch muối. Cô cạn dung dịch muối thu được muối ăn khan.
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.