Top 1000 câu hỏi thường gặp môn Hóa Học có đáp án (phần 21) hay nhất được biên soạn và chọn lọc giúp bạn ôn luyện và đạt kết quả cao trong bài thi môn Hóa Học.
Top 1000 câu hỏi thường gặp môn Hóa học có đáp án (phần 21)
Câu 1: Phản ứng nào sau đây không thể xảy ra:
A. FeSO4 + HCl → FeCl2 + H2SO4
B. Na2S + HCl → NaCl + H2S
C. FeSO4 + 2KOH → Fe(OH)2 + K2SO4
D. HCl + NaOH → NaCl + H2O
Lời giải:
Đáp án đúng là: A
Phản ứng B tạo khí, phản ứng C tạo kết tủa, phản ứng D tạo nước (thoả mãn các điều kiện của phản ứng trao đổi) nên có thể xảy ra.
Câu 2: Cân bằng phương trình hoá học sau:
FexOy + HCl → FeCl2y/x + H2O
Lời giải:
FexOy + 2yHCl → xFeCl2y/x + yH2O
Câu 3: Cân bằng phương trình hoá học sau:
FexOy + HCl → FeCl2 + FeCl3 + H2O
Lời giải:
FexOy + 2yHCl → (3x-2y)FeCl2 + (2y-2x)FeCl3 + yH2O
Câu 4: Hoàn thành và cân bằng sơ đồ phản ứng sau:
FexOy + O2 → FenOm (n > x ; m > y )
Lời giải:
Cân bằng Fe: nFexOy + O2 → xFenOm
Cân bằng O (Không cân bằng vào chỗ đã cân bằng là FexOy và FenOm):
Câu 5: Cân bằng phương trình: FexOy + O2 → Fe2O3
Lời giải:
Câu 6: Fructozơ + H2 Sobitol đúng hay sai?
Lời giải:
Đúng.
Fructozơ hay glucozơ tác dụng với H2 đều thu được cùng sản phẩm là sobitol.
C6H12O6 + H2 C6H14O6 (Sobitol).
Lời giải:
Frutozơ không làm mất màu dung dịch brom. Vì không có nhóm -CHO như glucozơ. Hơn nữa dung dịch nước brom có môi trường axit khiến cho fructozơ không thể chuyển hóa thành glucozơ như trong phản ứng tráng bạc được.
⇒ Dùng dung dịch brom làm thuốc thử phân biệt glucozơ và fructozơ
PTHH: C5H11O5CH=O + Br2 + H2O → C5H11O5COOH + 2HBr
Câu 8: Nguyên tử natri được cấu tạo bới 11p, 12n.
a, Tính khối lượng của natri theo gam, u.
b, Biết natri có bán kính nguyên tử gần đúng là 1,91. 10-10 m. Giả thiết rằng trong tinh thể natri các nguyên tử là những hình cầu, phần còn lại là các khe rỗng giữa các quả cầu chiếm 26% thể tích tinh thể. Tính khối lượng riêng của nguyên tử natri?
Lời giải:
a, Khối lượng của natri
Theo gam: 23.1,67.10-24 = 38,41.10-24 gam:
Theo u: 11 + 12 = 23u.
b, Bán kính nguyên tử là: 1,91.10-10 m = 1,91.10-8 cm.
Thể tích của nguyên tử natri: cm3.
Thể tích mol:
Khối lượng của nguyên tử natri là 23 (chính xác là 22,99)
Vậy khối lượng riêng của nguyên tử natri:
Câu 9: Dãy oxit nào sau đây đều bị khử bởi cacbon khi nung nóng ở nhiệt độ cao?
A. ZnO, CuO, PbO, K2O
B. CuO, Fe2O3, PbO, ZnO
C. CaO, CuO, Al2O3, FeO
D. BaO, CuO, PbO, ZnO
Lời giải:
Đáp án đúng là: B
Cacbon chỉ khử được oxit của những kim loại đứng sau nhôm trong dãy hoạt động hóa học của kim loại
2CuO + C 2Cu + CO2
2Fe2O3 + 3C 4Fe + 3CO2
2PbO + C 2Pb + CO2
2ZnO + C 2Zn + CO2
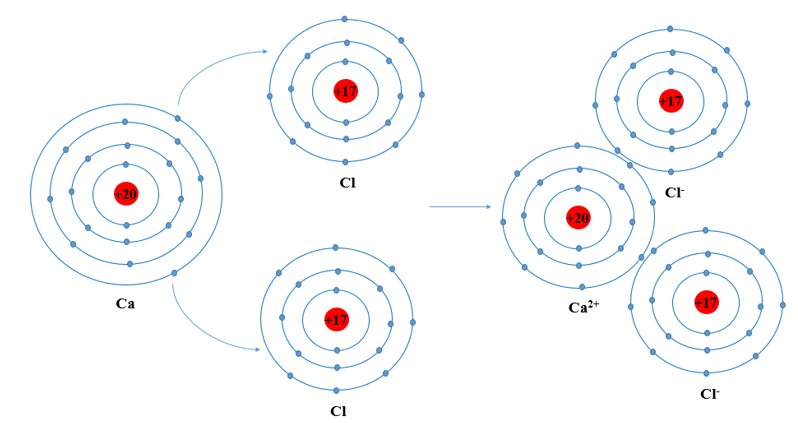
Câu 10: Giải thích sự hình thành phân tử CaCl2 và vẽ sơ đồ cho nhận electron?
Quá trình:
Các ion sinh ra mang điện tích trái dấu hút nhau tạo thành phân tử CaCl2.
Sơ đồ:
Lời giải
Ethanol là hợp chất phân cực, là alcohol nên có nhóm OH do đó tạo được liên kết hydrogen với nước, đồng thời gốc hydrocarbon của ethanol là gốc ethyl có M nhỏ nên ethanol tan vô hạn trong nước.
Phân tử khí nitrogen là phân tử không cực nên tương tác rất yếu với nước là hợp chất phân cực, do đó khí nitrogen tan kém trong nước.
Câu 12: Viết phương trình hóa học khi cho glucozơ tác dụng với AgNO3/NH3?
Lời giải:
Câu 13: Thế nào là anion gốc axit trong muối không có và có tính oxi hoá. Lấy ví dụ
+ Anion gốc axit có tính oxi hóa là các anion mà nguyên tử chính trong gốc đã đạt số oxi hóa tối đa (cùng điều kiện thích hợp) điều này khiến chúng chỉ có thể nhận electron (tính oxi hóa)
VD: , đạt số oxi hóa tối đa là +5
đạt số oxi hóa tối đa là +6 nhưng phải có điều kiện là đặc nóng mới thể hiện tính oxi hóa.
+ Anion không có tính oxi hóa là các anion mà nguyên tử chính của gốc axit chưa đạt tối đa (hay thiếu điều kiện)
VD: , Cl chưa đạt số oxi hóa tối đa là +7
loãng đạt số oxi hóa tối đa là +6 nhưng không có điều kiện là đặc nóng nên không thể hiện tính oxi hóa.
Các oxit có thể điềm chế đc từ cả hai phản ứng phân hủy và hóa hợp chỉ có H2O, CuO, CO2.
B. S và CuS;
C. Fe2S3, Al2S3;
D. Al(OH)3, Fe(OH)3.
Lời giải:
Đáp án đúng là: B
2FeCl3 + H2S → 2FeCl2 + S + 2HCl
AlCl3 + H2S → Không phản ứng
H2S + NH4Cl → Không phản ứng
CuCl2 + H2S → CuS + 2HCl
Vậy, kết tủa thu được là S và CuS.
Câu 16: Chất nào sau đây là chất điện li mạnh?
B. CH3COOH.
C. KMnO4.
D. C2H5OH.
Lời giải:
Đáp án đúng là: C
KMnO4 là muối tan nên là chất điện li mạnh.
Câu 17: AgNO3 tác dụng H2SO4 có hiện tượng gì?
Lời giải:
AgNO3 tác dụng H2SO4 có hiện tượng: Xuất hiện kết tủa màu trắng.
2AgNO3 + H2SO4 → Ag2SO4↓ + 2HNO3
Câu 18: H3PO4 không tác dụng dược với BaCl2? Vì sao?
Lời giải:
Để axit phản ứng với muối thì muối phải phải tan trong axit và 1 trong 3 điều sau:
+ Muối thu được sau phản ứng không tan trong axit
+ Sau phản ứng có khí thoát ra
+ Axit thu được phải yếu hơn axit phản ứng.
Giả sử có phản ứng: 2H3PO4 + 3BaCl2 → Ba3(PO4)2 + 6HCl
Þ Muối thu được sau phản ứng tan trong axit, không có khí thoát ra, axit sinh ra mạnh hơn axit phản ứng nên phản ứng này không xảy ra.
A. a ≤ b < 2a
B. a < 2b
C. a < b < 2a
D. a = 2b
Lời giải:
Đáp án đúng là: C
Để thu được hỗn hợp 2 muối thì
A. Công thức phân tử và công thức cấu tạo đều giống nhau.
B. Công thức phân tử và công thức cấu tạo đều khác nhau.
C. Công thức phân tử giống nhau nhưng công thức cấu tạo khác nhau.
D. Công thức phân tử khác nhau và công thức cấu tạo giống nhau.
Lời giải:
Đáp án đúng là: C
Hai chất HCOOCH3 và CH3COOH đều có công thức phân tử là C2H4O2. Nhưng khác công thức cấu tạo vì HCOOCH3 là este, CH3COOH là axit.
Lời giải:
- Gọi CTHH là X2O
%O = 100% - 25,8% = 74,2 %
- Tỉ lệ :
Nguyên tố cần tìm là Natri ( Na)
vậy CTHH là Na2O.
Lời giải:
NTK O2 = 32 (g/mol) > NTK CH4 = 16 (g/mol)
Nên quả bóng A lớn hơn quả bóng B.
a) Xác định kim loại R
b) Tính nồng độ mol của dung dịch thu được sau phản ứng.
Lời giải:
a)
nHCl = 0,05.2 = 0,1 (mol)
Có → R phản ứng hết
PTHH: 2R + 6HCl → 2RCl3 + 3H2
Theo PTHH:
Vậy R là nhôm (Al)
b) Dung dịch sau phản ứng gồm các chất: HCl dư, AlCl3.
Theo PTHH:
→ nHCl dư = 0,1 – 0,06 = 0,04 (mol)
Theo PTHH:
Nồng độ mol của dung dịch thu được sau phản ứng là:
A. Khí trong bình thủy tinh chuyển thành màu hồng;
B. Nước trong chậu từ không màu chuyển thành màu hồng;
C. Nước trong chậu phun vào bình thủy tinh thành những tia màu hồng;
D. Nước từ chậu tràn vào bình thủy tinh.
Lời giải:
Đáp án đúng là: C
NH3 tan nhiều trong nước làm giảm áp suất trong bình, tạo ra lực hút, do có tính bazơ nên khi phản ứng với phenolphtalein chuyển màu thành hồng.
|
(3) Hạt có thể xuất hiện với số lượng khác nhau trong các nguyên tử của cùng một nguyên tố. |
|
|
(6) Hạt có khối lượng rất nhỏ, có thể bỏ qua khi tính khối lượng nguyên tử. |
|
|
|
Lời giải:
|
Phát biểu |
Loại hạt |
|
(1) Hạt mang điện tích dương |
proton |
|
(2) Hạt được tìm thấy cùng với proton trong hạt nhân |
neutron |
|
(3) Hạt có thể xuất hiện với số lượng khác nhau trong các nguyên tử của cùng một nguyên tố. |
neutron |
|
(4) Hạt có trong lớp vỏ xung quanh hạt nhân. |
electron |
|
(5) Hạt mang điện tích âm. |
electron |
|
(6) Hạt có khối lượng rất nhỏ, có thể bỏ qua khi tính khối lượng nguyên tử. |
electron |
|
(7) Hạt không mang điện tích |
neutron |
Câu 26: Hãy cho biết 67,2 lít khí oxi (đktc)
b) Có bao nhiêu phân tử khí oxi?
c) Có khối lượng bao nhiêu gam?
d) Cần phải lấy bao nhiêu gam khí N2 để có số phan tử gấp 4 lần số phân tử có
trong 3,2 gam khí oxi?
Lời giải:
- Số mol oxi là:
- Số phân tử khí oxi là:
N = 3.6.1023 =18.1023 (phân tử)
- Khối lượng của khí oxi là:
= 3.32 = 96 gam
- Trong 3,2 gam khí oxi có số phân tử oxi là:
(phân tử)
→ Số phân tử nitơ = 4.0,6.1023 = 2,4.1023 (phân tử)
→ Số mol của nitơ:
→ Khối lượng nitơ cần lấy: = 0,4.28 = 11,2 gam.
Câu 27: Trong các chất sau, chất nào là đơn chất, chất nào là hợp chất?
b) Nước
c) Khí hydrogen (được tạo thàn từ nguyên tố H)
d) Vitamin C (được tạo thành từ các nguyên tố C, H và O)
e) Lưu huỳnh (được tạo thành từ nguyên tố S)
Lời giải
a) Đường ăn được tạo thành từ 3 nguyên tố C, H và O Þ Hợp chất
b) Nước được tạo thành từ 2 nguyên tố H và O Þ Hợp chất
c) Khí hydrogen được tạo thành từ 1 nguyên tố H Þ Đơn chất
d) Vitamin C được tạo thành từ 3 nguyên tố C, H và O Þ Hợp chất
e) Lưu huỳnh được tạo thành từ 1 nguyên tố S Þ Đơn chất
Câu 28: Hãy chọn dãy chất chỉ có oxit bazơ:
C. ZnO, CaO, FeO, MgO, Fe2O3.
D. SO2, CO2, P2O5, SiO2.
Lời giải:
Đáp án đúng là: C
Oxit bazơ là oxit của kim loại
Loại A vì NO là oxit trung tính
Loại B vì SO3 là oxit axit
Loại D vì SO2; CO2; P2O5; SiO2 là oxit axit.
Câu 29: Hãy chọn dãy chất chỉ có oxit bazơ.
B. ZnO, P2O5, Fe2O3.
C. ZnO, Na2O, CaO.
D. SO2, CO2, P2O5.
Lời giải
Đáp án đúng là: C
Oxit bazơ là oxit của kim loại
Loại A vì SO2 là oxit axit
Loại B vì P2O5 là oxit axit
Loại D vì SO2; CO2; P2O5 là oxit axit.
Câu 30: Hãy giải thích câu nói:
Hễ nghe tiếng sấm phấp cờ mà lên.
Lời giải:
Dựa vào sự hình thành nitơ (nitrogen) hữu cơ từ nitơ (nitrogen)vô cơ trong không khí dưới điều kiện sấm sét.
Thời kì tháng 3 lúa làm đòng đòi hỏi lượng đạm cao.
Vào lúc này mùa mưa giông bắt đầu. Khi có sấm sét:
N2 + O2 ⇄ 2NO
NO dễ dàng tác dụng với oxi không khí tạo thành NO2
2NO + O2 → 2NO2
NO2 kết hợp với oxi không khí và nước mưa tạo thành axit nitric
4NO2 + O2 + 2H2O → 4HNO3
Axit nitric rơi xuống đất kết hợp với một số khoáng chất trong đất tạo thành muối nitrat (đạm nitrat) cung cấp cho cây trồng.
Nhờ thêm “phân” lúc cần và nước mưa mát đầu mùa, đòng lúa nhanh chóng phát triển và vươn cao như phất cờ hội vậy.
Vì vậy trong mùa hè ít nắng nóng cây cối đều héo úa nhưng nếu có một trận mưa giông thì ngày hôm sau cây cối sẽ xanh tốt hơn.
Lời giải:
Cho quỳ tím vào từng mẫu thử :
+ Hóa đỏ: HCl, H2SO4 (Nhóm 1)
+ Không đổi màu: NaCl, Na2SO4 (nhóm 2)
Cho dung dịch BaCl2 vào nhóm 1:
+ Chất nào xuất hiện kết tủa trắng không tan trong axit: H2SO4
PTHH: BaCl2 + H2SO4 → BaSO4↓ + 2HCl
Không hiện tượng: HCl
Cho dung dịch BaCl2 ở trên vào nhóm 2 :
+ Chất nào xuất hiện kết tủa trắng: Na2SO4
PTHH: BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
Không hiện tượng: NaCl
Câu 32: Nhận biết các lọ mất nhãn sau: KOH, KCl, KNO3, K2SO4, H2SO4
Lời giải:
Cho giấy quỳ tím vào từng dung dịch cần nhận biết.
+ KOH: quỳ tím chuyển sang màu xanh
+ H2SO4: quỳ tím chuyển sang màu đỏ
+ KCl, KNO3, K2SO4: không hiện tượng
Nhỏ dung dịch BaCl2 vào ba dd còn lại. K2SO4 có kết tủa trắng, còn lại không hiện tượng
BaCl2 + K2SO4 → BaSO4↓ + 2KCl
Nhỏ dung dịch AgNO3 vào hai dd còn lại. KCl có kết tủa trắng, còn lại là KNO3.
AgNO3 + KCl → AgCl↓ + KNO3
Lời giải:
Lời giải:
%O = 100% − 63,53% − 8,23% = 28,24%
Ta có:
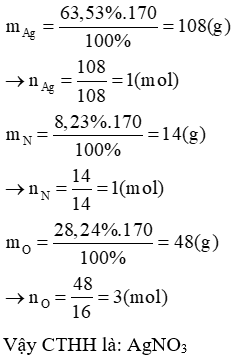
Lời giải:
nNaOH = 0,3.1 = 0,3 (mol)
→ Tạo muối trung hoà, NaOH dư
CO2 + 2NaOH → Na2CO3 + H2O
Lời giải:
BaCl2 + K2CO3 → BaCO3↓ + 2KCl (1)
trong X = = 0,06 (mol)
ban đầu = 0,1.0,2 = 0,02 (mol)
nKOH = 0,1.1,4 = 0,14 (mol)
TH1: KOH dư
2KOH + CO2 → K2CO3 + H2O (2)
ban đầu = 0,06 – 0,02 = 0,04 (mol)
TH2: CO2 dư
2KOH + CO2 → K2CO3 + H2O (3)
K2CO3 +H2O + CO2 → 2KHCO3 (4)
Câu 37: Trong 3 axit HCl, HNO3 và H2SO4 thì axit nào mạnh hơn axit nào? Hãy sắp xếp theo thứ tự?
Lời giải:
- Coi 3 dung dịch axit trên đều loãng , có cùng nồng độ và thể tích như nhau
- H2SO4 có tính axit mạnh nhất vì phân li ra nhiều H+ nhất
- Mà axit HCl chứa nhóm halogen, nhóm VIIA (Cl) nên tính axit mạnh hơn so với HNO3, nhóm VA (N)
(Có thể hiểu halogen có dạng X- nên dễ hút e hơn )
Vậy nên theo chiều tính axit tăng dần HNO3 < HCl < H2SO4
Câu 38: Vì sao K2SO4 không tác dụng với HCl?
Lời giải
Nếu xảy ra phản ứng trao đổi :
K2SO4 + 2HCl → 2KCl+ H2SO4
Hai chất KCl, H2SO4 được tạo thành không phải là kết tủa, chất dễ bay hơi hay chất điện li yếu.
Do đó, K2SO4 không tác dụng với HCl.
Câu 39: Vì sao Na2SO4 không tác dụng với HCl?
Lời giải
Nếu xảy ra phản ứng trao đổi :
Na2SO4 + 2HCl→ 2NaCl + H2SO4
Hai chất NaCl, H2SO4 được tạo thành không phải là kết tủa, chất dễ bay hơi hay chất điện li yếu.
Do đó, Na2SO4 không tác dụng với HCl.
Câu 40: Nhiệt phân NaHCO3; Ba(HCO3)2 như thế nào?
Lời giải:
Lời giải:
Đáp án đúng là: D
B. 6,02. 1023;
C. 5,35. 1020;
D. 2,67. 1020;
Lời giải:
Đáp án đúng là: C
Gọi x là phần trăm nguyên tử của đồng vị ta có:
2x + 1(1− x) = 1,008 ⇒ x = 0,008
D = 1 g/ml ⇒
1 mol H chứa 0,008.6,02.1023 đồng vị
mol chứa nguyên tử đồng vị
B. 2,2 – đimetylpropan;
C. Etan;
D. 2,2,3,3 – tetrametylbutan.
Lời giải:
Đáp án đúng là: B
Hidrocacbon X có thể tác dụng với clo là ankan: CnH2n+2
Þ CTPT của X: C5H12
Vì X tác dụng với Cl2 chỉ thu được 1 dẫn xuất monoclo duy nhất nên X có CTCT:
CH3 – C(CH3)2 – CH3. Tên gọi là 2,2 – đimetylpropan.
Câu 44: Nêu hiện tượng và viết phương trình hóa học khi đốt cháy sắt trong bình đựng oxi?
Hiện tượng: Sắt cháy mạnh, sáng chói, không có ngọn lửa, không có khói, tạo ra các hạt nhỏ nóng chảy màu nâu là sắt (II, III) oxit, công thức hoá học là Fe3O4 thường được gọi là oxit sắt từ. Màu trắng xám của sắt (Fe) dần chuyển sang màu nâu thành hợp chất Oxit sắt từ (Fe3O4).
PTHH:
Câu 45: Nêu hiện tượng và giải thích khi cho:
- Một miếng nhôm vào dung dịch CuSO4.
Lời giải:
- Hiện tượng: Có khí không màu thoát ra.
PTHH: Fe + 2HCl → FeCl2 + H2
- Hiện tượng: Có chất rắn màu nâu đỏ bám bên ngoài lá nhôm, màu xanh của dung dịch CuSO4 nhạt dần
PTHH: 2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
a) Nêu hiện tượng và viết PTHH. Khi cho viên Na vào dung dịch H2SO4 dư
b) Nêu hiện tượng và viết PTHH. Khi cho mẩu Ba dư vào dung dịch H2SO4 loãng.
Lời giải:
a) - Mẩu Na tan dần trong dd axit, có sủi bọt khí không màu mùi, tạo thành dd trong suốt không màu.
2Na + H2SO4 → Na2SO4 + H2↑
b) - Mẩu Ba tan dần trong dd axit, tạo thành kết tủa trắng lặn xuống đáy bình và dd trong suốt không màu, có sủi bọt khí không màu, toả nhiều nhiệt.
Ba + H2SO4 → BaSO4↓ + H2↑
Ba + 2H2O → Ba(OH)2 + H2↑
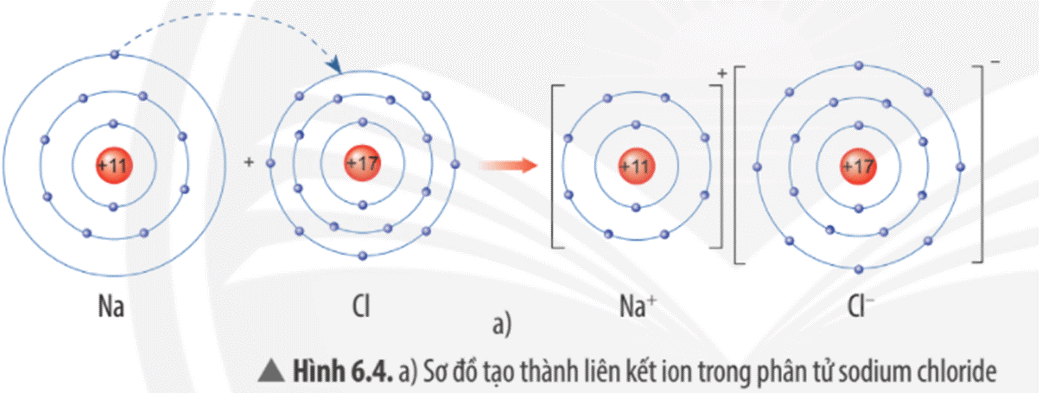 Lời giải:
Lời giải:
Mô tả quá trình tạo thành liên kết ion trong phân tử sodium chloride:
Khi nguyên tử sodium (Na) kết hợp với nguyên tử chlorine (Cl), nguyên tử Na nhường 1 electron tạo thành ion dương, kí hiệu là Na+, đồng thời nguyên tử Cl nhận 1 electron từ nguyên tử Na tạo thành ion âm, kí hiệu Cl-. Ion Na+ và Cl- hút nhau tạo phân tử sodium chloride (NaCl).
Một số ứng dụng của sodium chloride trong đời sống:
- Trong công nghiệp:
+ Sodium chloride dùng sản xuất giấy, thuốc nhuộm;…
+ Sử dụng trong công nghiệp dệt may và sản xuất vải, sản xuất xà phòng, chất tẩy rửa.
+ Nguyên liệu ban đầu để sản xuất chlorine và xút.
+ Trong công nghiệp sản xuất giày da, người ta sử dụng sodium chloride để bảo vệ da.
+ Trong sản xuất cao su, sodium chloride được dùng để làm trắng các loại cao su.
+ Trong dầu khí, sodium chloride là thành phần quan trọng trong dung dịch khoan giếng.
+ Từ sodium chloride có thể chế ra các loại hóa chất dùng trong các ngành khác như sản xuất nhôm, đồng, thép, điều chế nước Javen, … bằng cách điện phân nóng chảy hoặc điện phân dung dịch sodium chloride có màng ngăn.
- Trong nông nghiệp và trong đời sống:
+ Giúp cân bằng sinh lí trong cơ thể con người, gia súc, gia cầm, …
+ Cung cấp thêm vi lượng khi trộn với các loại phân hữu cơ để tăng hiệu quả của phân bón;
+ Sodium chloride có tính hút ẩm, do đó được sử dụng để bảo quản thực phẩm, nó làm tăng áp suất thẩm thấu khiến vi khuẩn mất nước và chết.
+ Sodium chloride dùng để ướp thực phẩm tươi sống như tôm, cá, … để không bị ươn, ôi trước khi thực phẩm được nấu, vận chuyển đi xa, …
- Trong y tế:
+ Sát trùng vết thương;
+ Pha huyết thanh, thuốc tiêu độc và một số loại thuốc khác để chữa bệnh,
+ Cung cấp muối khoáng cho cơ thể;
+ Khử độc, thanh lọc cơ thể, làm đẹp da, chữa viêm họng, hôi miệng …
B. 16;
C. 28;
D. 42.
Lời giải:
Đáp án đúng là: A
Vì thể tích A bằng thể tích của 1,6 gam O2 (đkc) nên
B. 1,2 mol;
C. 1,35 mol;
D. 0,4 mol.
Lời giải:
Đáp án đúng là: A
Không có khí thoát suy ra có muối NH4NO3
Quá trình trao đổi e:
Ta có:
B. 20,65 gam;
C. 42,05 gam;
D. 14,97 gam.
Lời giải:
Đáp án đúng là: A
= 0,3 mol → nNa + nK = 0,6 mol
Giải được số mol K, Na lần lượt là 0,2; 0,4 mol
= 0,075 mol; nHCl = 0,15 mol
Þ mmuối = 8,5 + 0,075.98 + 0,15.36,5 - 0,15.2 = 21,025 gam
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.