Toptailieu.vn biên soạn và giới thiệu phương trình phản ứng Mg + HNO3(đặc) → Mg(NO3)2 + NO2 + H2O. Đây là phản ứng oxi hóa khử, phương trình này sẽ xuất hiện trong nội dung các bài học: Cân bằng phản ứng oxi hóa khử Hóa học 10, tính chất Hóa học của Mg và tính chất hóa học HNO3(đặc).... cũng như các dạng bài tập. Bài viết giới thiệu các nội dung liên quan giúp học sinh nắm bắt kiến thức cơ bản. Mời các bạn đón đọc:
Nội dung bài viết
1. Phương trình phản ứng Mg tác dụng HNO3 đặc
Mg + 4HNO3 → Mg(NO3)2 + 2NO2 + 2H2O
Cách cân bằng phương trình phản ứng
Mg + HNO3 Mg(NO3)2 + NO2↑ + H2O
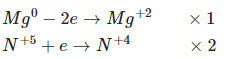
Phương trình hóa học: Mg + 4HNO3 → Mg(NO3)2 + 2NO2↑+ 2H2O
2. Axit nitric đặc tác dụng với kim loại
Axit nitric tác dụng với kim loại trừ Au và Pt tạo muối và nhiều sản phẩm oxi hóa khác nhau như NO2, NO, N2O ,N2, NH4NO3
Sản phẩm khử của N+5 sinh ra tùy thuộc vào độ mạnh yếu của kim loại và nồng độ của dung dịch axit, thông thường thì:
Dung dịch HNO3 đặc tác dụng với kim loại → NO2;
Dung dịch HNO3 loãng tác dụng với kim loại khử yếu (như: Cu, Pb, Ag,..) → NO;
Dung dịch HNO3 loãng tác dụng với kim loại mạnh (như: Al, Mg, Zn,...) thì N bị khử xuống mức
càng sâu → (N2, N2O, NH4NO3).
Cách phân biệt các khí sản phẩm sinh ra
N2O là khí gây cười
N2 không duy trì sự sống, sự cháy
NO2 có màu nâu đỏ
NO khí không màu nhưng bị oxit hóa thành NO2 màu nâu đỏ
NH4NO3 không sinh ra ở dạng khí, khi cho kiềm vào kim loại thấy có mùi khai amoniac NH3
3. Điều kiện phản ứng Mg tác dụng với dung dịch HNO3 đặc
Nhiệt độ thường
4. Cách tiến hành phản ứng cho Mg tác dụng với dung dịch HNO3 đặc
Cho vào ống nghiệm 1,2 lá magie, nhỏ từ từ vừa đủ dung dịch HNO3 đặc
5. Hiện tượng Hóa học xảy ra giữa phản ứng Mg HNO3 đặc
Lá magie Mg tan dần trong dung dịch axit HNO3đặc và sinh ra khí có màu nâu đỏ
NH4NO3 + NaOH → NaNO3 + NH3 + H2O
6. Bài tập vận dụng liên quan
Câu 1. Cho 5,6 gam Fe tác dụng hết với dung dịch HNO3 (dư). Sau phản ứng sinh ra V lít khí NO2 (ở đktc, sản phẩm khử duy nhất). Tính thể tích khí sinh ra?
A. 6,72 lít
B. 13,44 lít
C. 3,36 lít
D. 10,08 lít
Phương trình phản ứng hóa học
Fe + 6HNO3 → Fe(NO3)3 + 3NO2 + 3H2O
nFe= 5,6/56 = 0,1 mol
Theo phương trình
→ nNO2 = 3nFe=0,1 x 0,3= 0,3 mol
→ V = 0,3 x 22,4 = 6,72 lít
Câu 2. Nhúng thanh Al vào dung dịch HNO3 loãng, không thấy có khí thoát ra. Kết luận nào sao đây là đúng:
A. Al không phản ứng với dung dịch HNO3 loãng
B. Al bị thụ động hóa trong dung dịch HNO3 loãng
C. Al phản ứng với HNO3 tạo ra muối amoni
D. Cả A và B đều đúng
Nhúng thanh Al vào dung dịch HNO3 loãng, không thấy có khí thoát ra vì Al phản ứng với HNO3 tạo ra muối amoni.
Phương trình phản ưng minh họa
8Al + 30HNO3 → 8Al(NO3)3 + 3NH4NO3+ 9H2OCâu 3. Hiện tượng nào xảy ra khi cho mảnh đồng kim loại vào dd HNO3 loãng
A. không có hiện tượng gì
B. dung dịch có màu xanh, H2 bay ra
C. dung dịch có màu xanh, có khí màu nâu bay ra
D. dung dịch có màu xanh, có khí không màu bay ra, bị hoá nâu trong không khí.
Phương trình hóa học xảy ra
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
dung dịch có màu xanh, có khí không màu bay ra, bị hoá nâu trong không khí.
Câu 4. Hòa tan 38,4 gam Cu vào dd HNO3 loãng dư, thu được V lít khí NO (đktc, sản phẩm khử duy nhất). Giá trị của V:
A. 13,44
B. 8,96
C. 4,48
D. 17,92
Sử dụng bảo toàn e: nNO = 38,4/64.2/3 = 0,4 mol
=> V = 0,4.22,4 = 8,96 lít
Câu 5. Tiến hành thí nghiệm sau: thả một mẩu natri vào dung dịch chứa MgSO4.
Hiện tượng xảy ra được dự đoán như sau :
(a) Mẩu natri chìm xuống đáy dung dịch
(b) Kim loại magie màu trắng bạc thoát ra, lắng xuống đáy ống nghiệm.
(c) Dung dịch vẫn trong suốt.
(d) Có khí thoát ra.
Trong các hiện tượng trên, số hiện tượng xảy ra đúng như dự đoán là
A. 4
B. 2
C. 3
D. 1
Hiện tượng phản ứng xảy ra: Mẩu Na phản ứng với nước, tan dần, có khí không màu thoát ra, dần dần xuất hiện kết tủa trắng.
Phương trình hóa học xảy ra
2Na + 2H2O → 2NaOH + H2↑
MgSO4 + 2NaOH → Mg(OH)2 ↓trắng + Na2SO4
Câu 6. Có thể phân biệt 3 dung dịch: KOH, HCl, H2SO4 (loãng) bằng một thuốc thử là
A. Giấy quỳ tím
B. Zn
C. Al
D. BaCO3
Nếu chúng ta sử dụng quỳ tím chỉ có thể nhận biết được dung dịch NaOH
Dùng Zn, Al: không nhận biết được.
Dùng thuốc thử BaCO3
Cho BaCO3 lần lượt vào các dung dịch đã được đánh số thứ tự.
Dung dịch KOH không có hiện tượng
Dung dịch HCl có khí bay lên
Dung dịch H2SO4: có khí bay lên và kết tủa trắng
Phương trình phản ứng hóa học
BaCO3 + 2HCl → BaCl2 + CO2↑ + H2O
BaCO3 + H2SO4 → BaSO4↓ + CO2↑ + H2O
Câu 7. Một mẫu nước cứng có chứa thành phần các ion: Ca2+, Mg2+, HCO3-, Cl-, SO42-. Mẫu nước trên thuộc loại
A. nước cứng toàn phần.
B. nước cứng vĩnh cửu.
C. nước cứng tạm thời.
D. nước mềm.
Nước cứng toàn phần là nước chứa Mg2+, Ca2+, Cl-, SO42-, HCO3- .
Câu 8. Một hỗn hợp gồm hai bột kim loại Mg và Al được chia thành hai phần bằng nhau:
Phần 1: cho tác dụng với HCl dư thu được 6,72 lít H2.
Phần 2: hoà tan hết trong HNO3loãng dư thu được V lít một khí không màu, hoá nâu trong không khí . Biết các thể tích khí đều đo ở đktc, giá trị của V là
A. 2,24 lít.
B. 3,36 lít.
C. 4,48 lít.
D. 5,6 lít.
Phần 1: nH2= 0,3 mol
Bảo toàn e: ne cho = ne nhận = 2.nH2= 0,6 mol
Vì số mol của Mg và Al ở 2 phần bằng nhau và Mg, Al phản ứng với HCl hay với HNO3 đều có số oxi hóa như nhau
=> ne cho (phần 2) = ne cho (phần 1) = 0,6mol
Phần 2: khí không màu, hóa nâu trong không khí là NO
Bảo toàn e: ne cho (phần 2) = 3.nNO => nNO = 0,6/3 = 0,2 mol
=> VNO = 0,2.22,4 = 4,48 lít
Câu 9. Phát biểu nào sau đây khi nhắc đến các loại nước là đúng?
Nước chứa ít Ca2+, Mg2+ hay không có chứa 2 loại ion này là nước mềm.
A. Nước chứa ít Ca2+, Mg2+ hay không có chứa 2 loại ion này là nước mềm. => Đúng.
B. Nước có chứa nhiều ion Ca2+, Mg2+ là nước cứng. => Đúng
C. Nước cứng có chứa đồng thời các ion HCO3-, SO42-, Cl- là nước cứng toàn phần. => Đúng
D. Nước có chứa Cl- hay SO42- hoặc cả 2 loại ion này là nước cứng tạm thời= Sai. Nước cứng tạm thời chứa anion HCO3- .
Câu 10. Có các chất sau: NaNO3, Ca(OH)2, K2CO3, HCl . Cặp chất nào có thể làm mềm nước cứng tạm thời :
A. NaNO3 và Ca(OH)2
B. Ca(OH)2 và K2CO3
C. Na2CO3 và HCl
D. NaNO3 và HCl
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.