Toptailieu.vn biên soạn và giới thiệu cách viết Cấu hình electron của Ar (agon), argon theo chương trình sách mới của ba bộ sách Kết nối tri thức, Cánh diều, Chân trời sáng tạo giúp học sinh dễ dàng nắm vững cách viết Cấu hình electron của Ar (agon), argon từ đó học tốt môn Hóa học.
Nội dung bài viết
Cấu hình electron của Ar (agon), argon chương trình mới
I. Cấu hình electron của Ar (agon), argon chương trình mới
1. Cấu hình electron nguyên tử argon (Z = 18)
- Argon có số hiệu nguyên tử là 18 ⇒ nguyên tử Ar có 18 electron.
- Cấu hình electron nguyên tử Ar là 1s22s22p63s23p6.
Viết gọn: [Ne]3s23p6.
2. Cấu hình electron của nguyên tử argon (Z = 18) theo ô orbital
- Cấu hình electron của nguyên tử argon (Z = 18) theo ô orbital là:
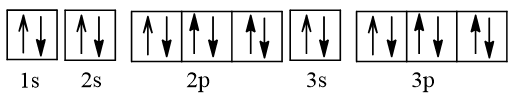
- Nguyên tử Ar không có electron độc thân.
3. Mối liên hệ giữa cấu hình electron với vị trí trong bảng tuần hoàn và tính chất nguyên tố
- Vị trí Ar trong bảng tuần hoàn:
Từ cấu hình electron của Ar là 1s22s22p63s23p6 ta xác định được:
+ Argon thuộc ô số 18 (do Z = 18)
+ Chu kì 3 (do có 3 lớp electron)
+ Nhóm VIIIA (do có 8 electron hóa trị, nguyên tố p).
+ Là nguyên tố p (do có cấu hình electron lớp ngoài cùng là 3s23p6).
- Tính chất nguyên tố:
+ Ar thuộc nhóm VIIIA nên Ar là khí hiếm (trơ về mặt hóa học).
4. Bài tập
Câu 1: Nguyên tử của nguyên tố X có electron cuối cùng điền vào phân lớp 3p. Tổng số electron phân lớp p gấp đôi số electron phân lớp s. Cấu hình electron của nguyên tử X là
A. 1s22s22p63s23p5.
B. 1s22s22p63s23p6.
C. 1s22s22p63s23p4.
D. 1s22s22p63s23p2.
Lời giải:
Đáp án đúng là: B
Nguyên tử của nguyên tố X có electron cuối cùng điền vào phân lớp 3p.
⇒ Cấu hình electron của nguyên tử X có dạng 1s22s22p63s23pa.
Theo bài, ta có: 6 + a = 2. (2 + 2 + 2)
⇒ a = 6
⇒ Cấu hình electron của nguyên tử X là 1s22s22p63s23p6.
Câu 2: Argon (Ar) có số hiệu nguyên tử là 18. Ar là nguyên tố
A. kim loại
B. phi kim
C. khí hiếm
D. kim loại hoặc phi kim
Hướng dẫn giải
Đáp án đúng là: C
Argon (Ar) có số hiệu nguyên tử là 18
⇒ Cấu hình electron nguyên tử của Ar: 1s22s22p63s23p6
⇒ Có 8 electron lớp ngoài cùng
⇒ Ar thuộc nhóm VIIIA. Là nguyên tố khí hiếm.
II. Cấu hình electron của Ar (agon) chương trình cũ
1. Cấu hình electron nguyên tử agon (Z = 18)
- Agon có số hiệu nguyên tử là 18 ⇒ nguyên tử Ar có 18 electron.
- Cấu hình electron nguyên tử agon là 1s2 2s2 2p6 3s2 3p6.
Viết gọn: [Ne]3s2 3p6.
2. Mối quan hệ giữa cấu hình electron với vị trí trong bảng tuần hoàn và tính chất nguyên tố
- Vị trí Ar trong bảng tuần hoàn:
+ Từ cấu hình electron của Ar là 1s2 2s2 2p6 3s2 3p6 ta xác định được nguyên tử Ar có 18 electron, phân bố trên 3 lớp electron và số electron lớp ngoài cùng bằng 8.
⇒ Vậy agon ở ô thứ 18 (do Z = 18); chu kì 3 (do có 3 lớp electron), nhóm VIIIA (do có 8 electron hóa trị, nguyên tố p).
- Tính chất nguyên tố:
+ Ar thuộc nhóm VIIIA nên Ar là khí hiếm.
3. Bài tập
Câu 1: Một nguyên tử Y có tổng số electron ở các phân lớp s là 6 và tổng số electron ở lớp ngoài cùng là 8. Y là nguyên tố hóa học nào?
A. S (Z = 16)
B. Cl (Z = 17)
C. Ar (Z = 18)
D. K (Z = 19)
Lời giải:
Đáp án C
Nguyên tử Y có tổng số electron ở các phân lớp s là 6
⇒ Các phân lớp s chứa electron của Y là 1s2, 2s2, 3s2.
Tổng số electron lớp ngoài cùng là 8
⇒ Cấu hình electron lớp ngoài cùng của Y là 3s23p6.
⇒ Cấu hình electron của Y là 1s2 2s2 2p6 3s2 3p6.
⇒ Nguyên tố Y là Ar (Agon)
Câu 2: Nguyên tử của nguyên tố X có electron cuối cùng điền vào phân lớp 3p. Tổng số electron phân lớp p gấp đôi số electron phân lớp s. Cấu hình electron của nguyên tử X là
A. 1s2 2s2 2p6 3s2 3p5.
B. 1s2 2s2 2p6 3s2 3p6.
C. 1s2 2s2 2p6 3s2 3p4.
D. 1s2 2s2 2p6 3s2 3p2.
Lời giải:
Đáp án B
Nguyên tử của nguyên tố X có electron cuối cùng điền vào phân lớp 3p.
⇒ Cấu hình electron của nguyên tử X có dạng 1s2 2s2 2p6 3s2 3pa.
Theo bài, ta có: 6 + a = 2. (2 + 2 + 2)
⇒ a = 6
⇒ Cấu hình electron của nguyên tử X là 1s2 2s2 2p6 3s2 3p6.
Xem thêm các bài giải Cấu hình electron của các nguyên tố chương trình mới hay, chi tiết khác:
Cấu hình electron của H, hydrogen (hiđro) chương trình mới
Cấu hình electron của He, helium (heli) chương trình mới
Cấu hình electron của Li, lithium (liti) chương trình mới
Cấu hình electron của Be, beryllium (beri) chương trình mới
Cấu hình electron của B, boron (bo) chương trình mới
Cấu hình electron của C, carbon (cacbon) chương trình mới
Cấu hình electron của N, nitrogen (nitơ) chương trình mới
Cấu hình electron của O, oxygen (oxi) chương trình mới
Cấu hình electron của F, fluorine (flo) chương trình mới
Cấu hình electron của Ne, neon chương trình mới
Cấu hình electron của Na, sodium (natri) chương trình mới
Cấu hình electron của Mg, magnesium (magie) chương trình mới
Cấu hình electron của Al, aluminium (nhôm) chương trình mới
Cấu hình electron của Si, silicon (silic) chương trình mới
Cấu hình electron của P, phosphorus (photpho) chương trình mới
Cấu hình electron của S, sulfur (lưu huỳnh) chương trình mới
Cấu hình electron của Cl, chlorine (clo) chương trình mới
Cấu hình electron của Ar, argon (agon) chương trình mới
Cấu hình electron của K, potassium (kali) chương trình mới
Cấu hình electron của Ca, calcium (canxi) chương trình mới
Cấu hình electron của Cr, chromium (crom) chương trình mới
Cấu hình electron của Ba, barium (bari) chương trình mới
Cấu hình electron của Co, cobalt (coban) chương trình mới
Cấu hình electron của Cu, copper (đồng) chương trình mới
Cấu hình electron của Au, gold (vàng) chương trình mới
Cấu hình electron của Mn, manganese (mangan) chương trình mới
Cấu hình electron của Ag, silver (bạc) chương trình mới
Cấu hình electron của Sr, strontium (stronti) chương trình mới
Cấu hình electron của Ti, titanium (titan) chương trình mới
Cấu hình electron của V, vanadium (vanadi) chương trình mới
Cấu hình electron của Xe, xenon chương trình mới
Cấu hình electron của Zn, zinc (kẽm) chương trình mới
Cấu hình electron của Fe, iron (sắt) chương trình mới
Cấu hình electron của Ni, nickel (niken) chương trình mới
Cấu hình electron của Rb, rubidium (rubidi) chương trình mới
Cấu hình electron nguyên tử của các nguyên tố thường gặp chương trình mới
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.