Toptailieu.vn biên soạn và giới thiệu cách viết Cấu hình electron theo chương trình sách mới của ba bộ sách Kết nối tri thức, Cánh diều, Chân trời sáng tạo giúp học sinh dễ dàng nắm vững cách viết Cấu hình electron từ đó học tốt môn Hóa học.
Nội dung bài viết
Cấu hình electron nguyên tử của các nguyên tố thường gặp chương trình mới
1. Cấu hình electron nguyên tử và cách viết cấu hình electron nguyên tử
- Khái niệm: Cấu hình electron nguyên tử biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau.
- Quy ước cách viết cấu hình electron nguyên tử:
+ Số thứ tự lớp electron được viết bằng các chữ số (1, 2, 3 …)
+ Phân lớp được kí hiệu bằng chữ cái thường (s, p, d, f)
+ Số electron được ghi bằng chỉ số ở phía trên, bên phải kí hiệu của phân lớp (s2; p6 …)
- Cách viết cấu hình electron nguyên tử:
+ Bước 1: Xác định số electron của nguyên tử (chú ý trong nguyên tử số electron = số proton = số hiệu nguyên tử = số thứ thự ô nguyên tố).
+ Bước 2: Điền electron theo thứ tự các mức năng lượng từ thấp đến cao (dãy Klechkovski) theo các nguyên lý và quy tắc phân bố electron trong nguyên tử:

Điền electron bão hòa phân lớp trước rồi mới điền tiếp vào phân lớp sau.
+ Bước 3: Đổi lại vị trí các phân lớp sao cho số thứ tự lớp (n) tăng dần từ trái qua phải, các phân lớp trong cùng một lớp theo thứ tự s, p, d, f.
Ví dụ: Viết cấu hình electron nguyên tử Fe (Z = 26):
Bước 1: Fe có Z = 26 nên có 26 electron trong nguyên tử.
Bước 2: Điền electron vào phân mức năng lượng: 1s22s22p63s23p64s23d6
Bước 3: Sắp xếp lại vị trí theo đúng thứ tự lớp và phân lớp.
⇒ Cấu hình electron nguyên tử Fe: 1s22s22p63s23p63d64s2
Viết gọn: [Ar]3d64s2.
Chú ý:
- Cách ghi nhớ trật tự phân mức năng lượng bằng cách sử dụng một số câu nói vui:
|
1s 2s |
2p 3s |
3p 4s |
3d 4p 5s |
4d 5p 6s |
4f 5d 6p 7s |
5f 6d 7p 8s |
|
son son |
phấn son |
phấn son |
đánh phấn son |
đánh phấn son |
fải đánh phấn son |
fải đánh phấn son |
|
sáng sớm |
phơi sắn |
phơi sắn |
đi phơi sắn |
đi phơi sắn |
fải đi phơi sắn |
fải đi phơi sắn |
- Quy tắc đường chéo xác định thứ tự mức năng lượng theo dãy Klechkovski như sau:
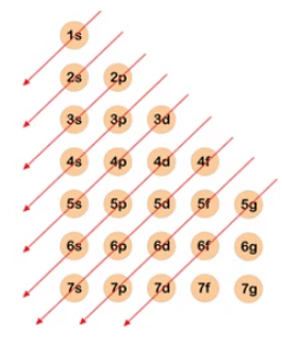
- Dưới đây là bảng cấu hình electron nguyên tử của các nguyên tố hay gặp:
2. Cấu hình electron của 20 nguyên tố đầu tiên trong bảng tuần hoàn
|
Z |
Tên nguyên tử |
Kí hiệu |
Cấu hình electron đầy đủ |
Cấu hình electron thu gọn |
Tính chất |
|
1 |
Hydrogen |
H |
1s1 |
|
Phi kim |
|
2 |
Helium |
He |
1s2 |
[He] |
Khí hiếm |
|
3 |
Lithium |
Li |
1s22s1 |
[He]2s1 |
Kim loại |
|
4 |
Beryllium |
Be |
1s22s2 |
[He]2s2 |
Kim loại |
|
5 |
Boron |
B |
1s22s22p1 |
[He]2s22p1 |
Phi kim |
|
6 |
Carbon |
C |
1s22s22p2 |
[He]2s22p2 |
Phi kim |
|
7 |
Nitrogen |
N |
1s22s22p3 |
[He]2s22p3 |
Phi kim |
|
8 |
Oxygen |
O |
1s22s22p4 |
[He]2s22p4 |
Phi kim |
|
9 |
Fluorine |
F |
1s22s22p5 |
[He]2s22p5 |
Phi kim |
|
10 |
Neon |
Ne |
1s22s22p6 |
[Ne] |
Khí hiếm |
|
11 |
Sodium
(natri) |
Na |
1s22s22p63s1 |
[Ne]3s1 |
Kim loại |
|
12 |
Magnessium |
Mg |
1s22s22p63s2 |
[Ne]3s2 |
Kim loại |
|
13 |
Aluminium (Nhôm) |
Al |
1s22s22p63s23p1 |
[Ne]3s23p1 |
Kim loại |
|
14 |
Silicon |
Si |
1s22s22p63s23p2 |
[Ne]3s23p2 |
Phi kim |
|
15 |
Phosphorus |
P |
1s22s22p63s23p3 |
[Ne]3s23p3 |
Phi kim |
|
16 |
Sulfur (Lưu huỳnh) |
S |
1s22s22p63s23p4 |
[Ne]3s23p4 |
Phi kim |
|
17 |
Chlorine |
Cl |
1s22s22p63s23p5 |
[Ne]3s23p5 |
Phi kim |
|
18 |
Argon |
Ar |
1s22s22p63s23p6 |
[Ar] |
Khí hiếm |
|
19 |
Potassium (kali) |
K |
1s22s22p63s23p64s1 |
[Ar]4s1 |
Kim loại |
|
20 |
Calcium (canxi) |
Ca |
1s22s22p63s23p64s2 |
[Ar]4s2 |
Kim loại |
Một số cấu hình electron đặc biệt
Theo quy tắc thì cấu hình electron của Cr và Cu là:
Cr (Z = 24): 1s22s22p63s23p63d44s2 hay [Ar]3d44s2
Cu (Z = 29): 1s22s22p63s23p63d94s2 hay [Ar] 3d94s2
Tuy nhiên, cấu hình electron này không bền vững nên một electron của phân lớp 4s chuyển sang phân lớp 3d để đạt cấu hình electron bền vững hơn (trạng thái bão bán bão hòa ở Cr và bão hòa ở Cu).
⇒ Cấu hình electron của Cr và Cu thực tế là:
Cr (Z = 24): 1s22s22p63s23p63d54s1 hay [Ar]3d54s1
Cu (Z = 29): 1s22s22p63s23p63d104s1 hay [Ar] 3d104s1.
3. Cấu hình electron một số nguyên tố nhóm B thường gặp (Z = 21 đến Z = 30)
|
Z |
Tên nguyên tử |
Kí hiệu |
Cấu hình electron đầy đủ |
Cấu hình electron thu gọn |
|
21 |
Scandium |
Sc |
1s22s22p63s23p63d14s2 |
[Ar]3d14s2 |
|
22 |
Titanium |
Ti |
1s22s22p63s23p63d24s2 |
[Ar]3d24s2 |
|
23 |
Vanadium |
V |
1s22s22p63s23p63d34s2 |
[Ar]3d34s2 |
|
24 |
Chromium |
Cr |
1s22s22p63s23p63d54s1 |
[Ar]3d54s1 |
|
25 |
Manganese |
Mn |
1s22s22p63s23p63d54s2 |
[Ar]3d54s2 |
|
26 |
Iron (sắt) |
Fe |
1s22s22p63s23p63d64s2 |
[Ar]3d64s2 |
|
27 |
Cobalt |
Co |
1s22s22p63s23p63d74s2 |
[Ar]3d74s2 |
|
28 |
Nickel |
Ni |
1s22s22p63s23p63d84s2 |
[Ar]3d84s2 |
|
29 |
Copper (đồng) |
Cu |
1s22s22p63s23p63d104s1 |
[Ar] 3d104s1 |
|
30 |
Zinc (kẽm) |
Zn |
1s22s22p63s23p63d104s2 |
[Ar] 3d¹⁰4s² |
4. Cấu hình electron nguyên tử của các nguyên tố trong bảng tuần hoàn
|
Z |
Tên nguyên tử |
Kí hiệu |
Cấu hình electron thu gọn |
Tính chất |
|
1 |
Hydrogen |
H |
|
Phi kim |
|
2 |
Helium |
He |
[He] |
Khí hiếm |
|
3 |
Lithium |
Li |
[He]2s1 |
Kim loại |
|
4 |
Beryllium |
Be |
[He]2s2 |
Kim loại |
|
5 |
Boron |
B |
[He]2s22p1 |
Phi kim |
|
6 |
Carbon |
C |
[He]2s22p2 |
Phi kim |
|
7 |
Nitrogen (nitơ) |
N |
[He]2s22p3 |
Phi kim |
|
8 |
Oxygen (oxi) |
O |
[He]2s22p4 |
Phi kim |
|
9 |
Fluorine (flo) |
F |
[He]2s22p5 |
Phi kim |
|
10 |
Neon |
Ne |
[Ne] |
Khí hiếm |
|
11 |
Sodium (natri) |
Na |
[Ne]3s1 |
Kim loại |
|
12 |
Magnesium (magie) |
Mg |
[Ne]3s2 |
Kim loại |
|
13 |
Aluminium (nhôm) |
Al |
[Ne]3s23p1 |
Kim loại |
|
14 |
Silicon (silic) |
Si |
[Ne]3s23p2 |
Phi kim |
|
15 |
Phosphorus (photpho) |
P |
[Ne]3s23p3 |
Phi kim |
|
16 |
Sulfur (Lưu huỳnh) |
S |
[Ne]3s23p4 |
Phi kim |
|
17 |
Chlorine (clo) |
Cl |
[Ne]3s23p5 |
Phi kim |
|
18 |
Argon |
Ar |
[Ar] |
Khí hiếm |
|
19 |
Potassium (kali) |
K |
[Ar]4s1 |
Kim loại |
|
20 |
Calcium (canxi) |
Ca |
[Ar]4s2 |
Kim loại |
|
21 |
Scandium |
Sc |
[Ar]3d14s2 |
Kim loại |
|
22 |
Titanium |
Ti |
[Ar]3d24s2 |
Kim loại |
|
23 |
Vanadium |
V |
[Ar]3d34s2 |
Kim loại |
|
24 |
Chromium (crom) |
Cr |
[Ar]3d54s1 |
Kim loại |
|
25 |
Manganese (mangan) |
Mn |
[Ar]3d54s2 |
Kim loại |
|
26 |
Iron (sắt) |
Fe |
[Ar]3d64s2 |
Kim loại |
|
27 |
Cobaly |
Co |
[Ar]3d74s2 |
Kim loại |
|
28 |
Nickel |
Ni |
[Ar]3d84s2 |
Kim loại |
|
29 |
Copper (đồng) |
Cu |
[Ar] 3d104s1 |
Kim loại |
|
30 |
Zinc (kẽm) |
Zn |
[Ar] 3d¹⁰4s² |
Kim loại |
|
31 |
Gallium |
Ga |
[Ar] 3d¹⁰4s²4p1 |
Kim loại |
|
32 |
Germanium |
Ge |
[Ar] 3d¹⁰4s²4p2 |
Kim loại |
|
33 |
Arsenic |
As |
[Ar] 3d¹⁰4s²4p3 |
Phi kim |
|
34 |
Selenium |
Se |
[Ar] 3d¹⁰4s²4p4 |
Phi kim |
|
35 |
Bromine (brom) |
Br |
[Ar] 3d¹⁰4s²4p5 |
Phi kim |
|
36 |
Krypton |
Kr |
[Ar] 3d¹⁰4s²4p6 |
Khí hiếm |
|
37 |
Rubidium |
Rb |
[Kr] 5s1 |
Kim loại |
|
38 |
Strontium |
Sr |
[Kr] 5s2 |
Kim loại |
|
39 |
Yttrium |
Y |
[Kr] 4d15s2 |
Kim loại |
|
40 |
Zirconium |
Zr |
[Kr] 4d25s2 |
Kim loại |
|
41 |
Niobium |
Nb |
[Kr] 4d45s1 |
Kim loại |
|
42 |
Molybdenum |
Mo |
[Kr] 4d55s1 |
Kim loại |
|
43 |
Technetium |
Tc |
[Kr] 4d55s2 |
Kim loại |
|
44 |
Ruthenium |
Ru |
[Kr] 4d75s2 |
Kim loại |
|
45 |
Rhodium |
Rh |
[Kr] 4d85s1 |
Kim loại |
|
46 |
Palladium |
Pd |
[Kr] 4d10 |
Kim loại |
|
47 |
Silver (bạc) |
Ag |
[Kr] 4d105s1 |
Kim loại |
|
48 |
Cadmium |
Cd |
[Kr] 4d105s2 |
Kim loại |
|
49 |
Indium |
In |
[Kr]4d105s25p1 |
Kim loại |
|
50 |
Tin (thiếc) |
Sn |
[Kr]4d105s25p2 |
Kim loại |
|
51 |
Antimony |
Sb |
[Kr]4d105s25p3 |
Kim loại |
|
52 |
Tellurium |
Te |
[Kr]4d105s25p4 |
Phi kim |
|
53 |
Iodine (iot) |
I |
[Kr]4d105s25p5 |
Phi kim |
|
54 |
Xenon |
Xe |
[Kr]4d105s25p6 |
Khí hiếm |
|
55 |
Caesium |
Cs |
[Xe]6s1 |
Kim loại |
|
56 |
Barium (bari) |
Ba |
[Xe]6s2 |
Kim loại |
|
57 |
Lanthanum |
La |
[Xe]5d16s2 |
Kim loại |
|
58 |
Cerium |
Ce |
[Xe]4f15d16s2 |
Kim loại |
|
59 |
Praseodymium |
Pr |
[Xe]4f36s2 |
Kim loại |
|
60 |
Neodymium |
Nd |
[Xe]4f46s2 |
Kim loại |
|
61 |
Promethium |
Pm |
[Xe]4f56s2 |
Kim loại |
|
62 |
Samarium |
Sm |
[Xe]4f66s2 |
Kim loại |
|
63 |
Europium |
Eu |
[Xe]4f76s2 |
Kim loại |
|
64 |
Gadolinium |
Gd |
[Xe]4f75d16s2 |
Kim loại |
|
65 |
Terbium |
Tb |
[Xe]4f96s2 |
Kim loại |
|
66 |
Dysprosium |
Dy |
[Xe]4f106s2 |
Kim loại |
|
67 |
Holmium |
Ho |
[Xe]4f116s2 |
Kim loại |
|
68 |
Erbium |
Er |
[Xe]4f126s2 |
Kim loại |
|
69 |
Thulium |
Tm |
[Xe]4f136s2 |
Kim loại |
|
70 |
Ytterbium |
Yb |
[Xe]4f146s2 |
Kim loại |
|
71 |
Lutetium |
Lu |
[Xe]4f145d16s2 |
Kim loại |
|
72 |
Hafnium |
Hf |
[Xe]4f145d26s2 |
Kim loại |
|
73 |
Tantalum |
Ta |
[Xe]4f145d36s2 |
Kim loại |
|
74 |
Tungsten |
W |
[Xe]4f145d46s2 |
Kim loại |
|
75 |
Rhenium |
Re |
[Xe]4f145d56s2 |
Kim loại |
|
76 |
Osmium |
Os |
[Xe]4f145d66s2 |
Kim loại |
|
77 |
Iridium |
Ir |
[Xe]4f145d76s2 |
Kim loại |
|
78 |
Platinum |
Pt |
[Xe]4f145d96s1 |
Kim loại |
|
79 |
Gold (vàng) |
Au |
[Xe]4f145d106s1 |
Kim loại |
|
80 |
Mercury (Thủy ngân) |
Hg |
[Xe]4f145d106s2 |
Kim loại |
|
81 |
Thallium |
Tl |
[Xe]4f145d106s26p1 |
Kim loại |
|
82 |
Lead (chì) |
Pb |
[Xe]4f145d106s26p2 |
Kim loại |
|
83 |
Bismuth |
Bi |
[Xe]4f145d106s26p3 |
Kim loại |
|
84 |
Polonium |
Po |
[Xe]4f145d106s26p4 |
Kim loại |
|
85 |
Astatine |
At |
[Xe]4f145d106s26p5 |
Kim loại |
|
86 |
Radon |
Rn |
[Xe]4f145d106s26p6 |
Khí hiếm |
|
87 |
Francium |
Fr |
[Rn]7s1 |
Kim loại |
|
88 |
Radium |
Ra |
[Rn]7s2 |
Kim loại |
|
89 |
Actinium |
Ac |
[Rn]6d17s2 |
Kim loại |
|
90 |
Thorium |
Th |
[Rn]6d27s2 |
Kim loại |
|
91 |
Protactinium |
Pa |
[Rn]5f26d17s2 |
Kim loại |
|
92 |
Uranium |
U |
[Rn]5f36d17s2 |
Kim loại |
|
93 |
Neptunium |
Np |
[Rn]5f46d17s2 |
Kim loại |
|
94 |
Plutonium |
Pu |
[Rn]5f67s2 |
Kim loại |
|
95 |
Americium |
Am |
[Rn]5f77s2 |
Kim loại |
|
96 |
Curium |
Cm |
[Rn]5f76d17s2 |
Kim loại |
|
97 |
Berkelium |
Bk |
[Rn]5f97s2 |
Kim loại |
|
98 |
Californium |
Cf |
[Rn]5f107s2 |
Kim loại |
|
99 |
Einsteinium |
Es |
[Rn]5f117s2 |
Kim loại |
|
100 |
Fermium |
Fm |
[Rn]5f127s2 |
Kim loại |
|
101 |
Mendelevium |
Md |
[Rn]5f137s2 |
Kim loại |
|
102 |
Nobelium |
No |
[Rn]5f147s2 |
Kim loại |
|
103 |
Lawrencium |
Lr |
[Rn]5f147s27p1 |
Kim loại |
|
104 |
Rutherfordium |
Rf |
[Rn]5f146d27s2 |
Kim loại |
|
105 |
Dubnium |
Db |
*[Rn]5f146d37s2 |
Kim loại |
|
106 |
Seaborgium |
Sg |
*[Rn]5f146d47s2 |
Kim loại |
|
107 |
Bohrium |
Bh |
*[Rn]5f146d57s2 |
Kim loại |
|
108 |
Hassium |
Hs |
*[Rn]5f146d67s2 |
Kim loại |
|
109 |
Meitnerium |
Mt |
*[Rn]5f146d77s2 |
Kim loại |
|
110 |
Darmstadtium |
Ds |
*[Rn]5f146d97s1 |
Kim loại |
|
111 |
Roentgenium |
Rg |
*[Rn]5f146d107s1 |
Kim loại |
|
112 |
Copernicium |
Cn |
*[Rn]5f146d107s2 |
Kim loại |
|
113 |
Nihonium |
Nh |
*[Rn]5f146d107s27p1 |
Kim loại |
|
114 |
Flerovium |
Fl |
*[Rn]5f146d107s27p2 |
Kim loại |
|
115 |
Moscovium |
Mc |
*[Rn]5f146d107s27p3 |
Kim loại |
|
116 |
Livermorium |
Lv |
*[Rn]5f146d107s27p4 |
Kim loại |
|
117 |
Tennessine |
Ts |
*[Rn]5f146d107s27p5 |
Kim loại |
|
118 |
Oganesson |
Og |
*[Rn]5f146d107s27p6 |
Khí hiếm |
* Cấu hình electron được dự đoán.
5. Biểu diễn cấu hình electron theo ô orbital
- Biểu diễn cấu hình electron theo orbital (còn gọi là cách biểu diễn cấu hình theo ô lượng tử) là một cách biểu diễn sự phân bố electron theo orbital, ta có thể biết được nguyên tử có bao nhiêu electron độc thân, electron độc thân đó nằm ở orbital nào, từ đó thuận lợi cho việc dự đoán trạng thái lai hóa, giải thích sự hình thành liên kết hóa học, ...
- Để biểu diễn cấu hình electron theo ô orbital ta cần nhớ 2 nguyên lý và 1 quy tắc
+ Nguyên lý vững bền: Ở trạng thái cơ bản, các electron trong nguyên tử chiếm lần lượt những orbital có mức năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p …
+ Nguyên lí Pauli: Mỗi orbital chỉ chứa tối đa 2 electron và có chiều tự quay ngược nhau.
+ Quy tắc Hund: Trong cùng một phân lớp chưa bão hòa, các electron sẽ phân bố vào các orbital sao cho số electron độc thân là tối đa.
- Các bước biểu diễn cấu hình electron theo orbital:
+ Bước 1: Viết cấu hình electron của nguyên tử
+ Bước 2: Biểu diễn mỗi AO bằng một ô vuông (orbital hay ô lượng tử), các AO trong cùng phân lớp thì viết liền nhau, các AO khác phân lớp thì viết tách nhau. Thứ tự các ô orbital từ trái sang phải theo thứ tự như ở cấu hình electron.
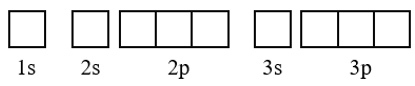
+ Bước 3: Điền electron vào từng ô orbital theo thứ tự lớp và phân lớp, mỗi electron biểu diễn bằng một mũi tên.
Lưu ý:
- Trong mỗi phân lớp, electron được phân bố sao cho số electron độc thân là lớn nhất, electron được điền vào các orbital theo thứ tự từ trái sang phải.
- Trong một ô orbital, electron đầu tiên được biểu diễn bằng mũi tên quay lên, electron thứ hai được biểu diễn bằng mũi tên quay xuống.
Ví dụ: Biểu diễn cấu hình electron nguyên tử O (Z = 8) theo ô orbital
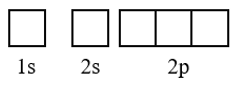
Bước 1: Nguyên tử O (Z = 8) có cấu hình electron nguyên tử là 1s22s22p4.
Bước 2: Thứ tự các ô orbital của nguyên tử O:
Bước 3: Cấu hình theo orbital của O như sau:
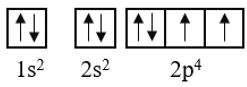
Như vậy, nguyên tử oxygen có 2 elctron độc thân, thuộc AO 2p.
Mở rộng: Electron mang điện tích âm nên hai electron trong cùng một AO sẽ đẩy nhau, vì vậy chúng có xu hướng tách nhau ra và chiếm hai AO khác nhau. Đây là lí do vì sao trong một phân lớp, các electron cần được sắp xếp sao cho số electron độc thân là lớn nhất.
- Dưới đây là bảng cấu hình electron nguyên tử của các nguyên tố theo ô orbital hay gặp:
|
Z |
Kí hiệu nguyên tử |
Cấu hình electron đầy đủ |
Orbital |
Số electron độc thân |
|
1 |
H |
1s1 |
|
1 |
|
2 |
He |
1s2 |
|
0 |
|
3 |
Li |
1s22s1 |
|
1 |
|
4 |
Be |
1s22s2 |
|
0 |
|
5 |
B |
1s22s22p1 |
|
1 |
|
6 |
C |
1s22s22p2 |
|
2 |
|
7 |
N |
1s22s22p3 |
|
3 |
|
8 |
O |
1s22s22p4 |
|
2 |
|
9 |
F |
1s22s22p5 |
|
1 |
|
10 |
Ne |
1s22s22p6 |
|
0 |
|
11 |
Na |
1s22s22p63s1 |
|
1 |
|
12 |
Mg |
1s22s22p63s2 |
|
0 |
|
13 |
Al |
1s22s22p63s23p1 |
|
1 |
|
14 |
Si |
1s22s22p63s23p2 |
|
2 |
|
15 |
P |
1s22s22p63s23p3 |
|
3 |
|
16 |
S |
1s22s22p63s23p4 |
|
2 |
|
17 |
Cl |
1s22s22p63s23p5 |
|
1 |
|
18 |
Ar |
1s22s22p63s23p6 |
|
0 |
|
19 |
K |
1s22s22p63s23p64s1 |
|
1 |
|
20 |
Ca |
1s22s22p63s23p64s2 |
|
0 |
Xem thêm các bài giải Cấu hình electron của các nguyên tố chương trình mới hay, chi tiết khác:
Cấu hình electron của H, hydrogen (hiđro) chương trình mới
Cấu hình electron của He, helium (heli) chương trình mới
Cấu hình electron của Li, lithium (liti) chương trình mới
Cấu hình electron của Be, beryllium (beri) chương trình mới
Cấu hình electron của B, boron (bo) chương trình mới
Cấu hình electron của C, carbon (cacbon) chương trình mới
Cấu hình electron của N, nitrogen (nitơ) chương trình mới
Cấu hình electron của O, oxygen (oxi) chương trình mới
Cấu hình electron của F, fluorine (flo) chương trình mới
Cấu hình electron của Ne, neon chương trình mới
Cấu hình electron của Na, sodium (natri) chương trình mới
Cấu hình electron của Mg, magnesium (magie) chương trình mới
Cấu hình electron của Al, aluminium (nhôm) chương trình mới
Cấu hình electron của Si, silicon (silic) chương trình mới
Cấu hình electron của P, phosphorus (photpho) chương trình mới
Cấu hình electron của S, sulfur (lưu huỳnh) chương trình mới
Cấu hình electron của Cl, chlorine (clo) chương trình mới
Cấu hình electron của Ar, argon (agon) chương trình mới
Cấu hình electron của K, potassium (kali) chương trình mới
Cấu hình electron của Ca, calcium (canxi) chương trình mới
Cấu hình electron của Cr, chromium (crom) chương trình mới
Cấu hình electron của Ba, barium (bari) chương trình mới
Cấu hình electron của Co, cobalt (coban) chương trình mới
Cấu hình electron của Cu, copper (đồng) chương trình mới
Cấu hình electron của Au, gold (vàng) chương trình mới
Cấu hình electron của Mn, manganese (mangan) chương trình mới
Cấu hình electron của Ag, silver (bạc) chương trình mới
Cấu hình electron của Sr, strontium (stronti) chương trình mới
Cấu hình electron của Ti, titanium (titan) chương trình mới
Cấu hình electron của V, vanadium (vanadi) chương trình mới
Cấu hình electron của Xe, xenon chương trình mới
Cấu hình electron của Zn, zinc (kẽm) chương trình mới
Cấu hình electron của Fe, iron (sắt) chương trình mới
Cấu hình electron của Ni, nickel (niken) chương trình mới
Cấu hình electron của Rb, rubidium (rubidi) chương trình mới
Cấu hình electron nguyên tử của các nguyên tố thường gặp chương trình mới
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.