Toptailieu.vn biên soạn và giới thiệu phương trình phản ứng 2KCl + 2H2O -dpdd→ 2KOH + Cl2 + H2. Phản ứng 2KCl + 2H2O -dpdd→ 2KOH + Cl2 + H2 thuộc loại phản ứng oxi hóa khử, phản ứng điện phân dung dịch đã được cân bằng chính xác và chi tiết nhất. Bài viết giới thiệu các nội dung liên quan giúp học sinh nắm bắt kiến thức cơ bản. Mời các bạn đón đọc:
Nội dung bài viết
1. Phương trình phản ứng hóa học:
2KCl + 2H2O -dpdd→ 2KOH + Cl2 + H2
2. Hiện tượng nhận biết phản ứng
- Có khí vàng lục, mùi xốc thoát ra ở cực dương, khí không màu thoát ra ở cực âm.
3. Điều kiện phản ứng
- điện phân dung dịch
4. Tính chất hóa học
– KCl là một muối trung hòa nó mang đầy đủ tính chất hóa học của muối.
– Phân ly toàn trong nước tạo thành các ion âm và ion dương:
KCL → K+ + Cl–
– Phản ứng với dung dịch chứa AgNO3
KCl + AgNO3 → AgCl ↓ + KNO3
– Kali Clorua là muối được tạo từ bazơ mạnh và axit mạnh nên nó mang tính trung tính; do đó tương đối trơ về mặt hóa học.
– Phản ứng với H2SO4 đặc để tạo ra K2SO4 và HCL
2KCl + H2SO4 đặc → K2SO4 + 2HCl
– Kali clorua được sử dụng làm nguyên liệu để điều chế kim loại kali trong công nghiệp (thay thế bằng kim loại natri ở nhiệt độ cao 850 ° C
KCL + Na → K + NaCl
5. Cách thực hiện phản ứng
- điện phân dung dịch KCl.
6. Bạn có biết
- Nếu điện phân không có màng ngăn Cl2 thoát ra ở cực dương sẽ tác dụng với KOH ở cực âm.
7. Bài tập liên quan
Ví dụ 1: Phương pháp nào sau đây dung để điều chế kim loại K?
A. điện phân nóng chảy KCl.
B. điện phân dung dịch KCl.
C. Cho Cu phản ứng với KCl.
D. Nhiệt phân KCl.
Hướng dẫn giải
Phương pháp điện phân nóng chảy dung để điều chế các kim loại hoạt động mạnh như Na, K, Ca…
Đáp án A.
Ví dụ 2: Thể tích khí ở dktc thoát ra ở cực dương khi điện phân dung dịch chứa 7,45 gam KCl là
A. 1,12 lít.
B. 2,24 lít.
C. 3,36 lít.
D. 4,48 lít.
Hướng dẫn giải
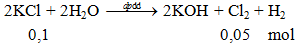
V = 0,05.22,4 = 1,12 lít.
Đáp án A.
Ví dụ 3: Khi điện phân dung dịch KCl, khí clo sinh ra ở
A. catot.
B. cực âm.
C. anot.
D. màng ngăn.
Hướng dẫn giải
clo sinh ra ở cực dương hay anot
Đáp án C.
Ví dụ 4: Sản phẩm thu được khi điện phân dung dịch KCl (điện cực trơ, màng ngăn xốp) là
A. K và Cl2.
B. K, H2 và Cl2.
C. KOH, H2 và Cl2.
D. KOH, O2 và HCl.
Đáp án C
Hướng dẫn giải
Cl- (cực dương) ← KCl, H2O → K+ (cực âm)
2Cl- → Cl2+ 2e 2H2O + 2e →H2+ 2OH-
Phương trình điện phân:
2KCl + 2H2O → 2KOH + Cl2 + H2
Vậy sản phẩm thu được là KOH, Cl2, H2.
Ví dụ 5: Người ta thường điều chế Clo trong phòng thí nghiệm bằng cách:
A. điện phân nóng chảy KCl.
B. cho dung dịch HCl đặc tác dụng với MnO2, đun nóng.
C. điện phân dung dịch KCl có màng ngăn.
D. cho F2đẩy Cl2 ra khỏi dung dịch NaCl.
Đáp án B
Hướng dẫn giải
Để điều chế clo ta cho dung dịch HCl đặc tác dụng với MnO2, đun nóng
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
Ví dụ 6: Cho kim loại M tác dụng với Cl2 được muối A; cho kim loại R tác dụng với dung dịch HCl được muối B. Nếu cho kim loại R tác dụng với dung dịch muối A ta cũng được muối B. Kim loại R có thể là
A. Mg.
B. Fe.
C. Al.
D. Zn.
Đáp án B
Hướng dẫn giải
M là kim loại Fe
2Fe + 3Cl2 ⟶ 2FeCl3 (X)
Fe + 2HCl ⟶ FeCl2(Y) + H2↑
Fe + 2FeCl3 (X) ⟶ 3FeCl2(Y)
Ví dụ 7: Đốt cháy 11,9 gam hỗn hợp gồm Zn, Al trong khí Cl2 dư. Sauk hi các phản ứng xảy ra hoàn toàn, thu được 40,3 gam hỗn hợp muối. Thể tích khí Cl2 (đktc) đã phản ứng là
A. 17,92 lít.
B. 6,72 lít.
C. 8,96 lít.
D. 11,20 lít.
Đáp án C
Hướng dẫn giải
Bảo toàn khối lượng : mCl2 = mmuối– mKL = 28,4g
=> nCl2 = 0,4 mol => V = 8,96 lit
Ví dụ 8: Khí clo có thể tác dụng được với tất cả các chất trong dãy nào sau đây?
A. H2, dung dịch NaOH, H2O
B. H2, dung dịch NaCl, dung dịch NaOH
C. H2, O2, Al
D. O2, Fe, Cu
Đáp án A
Hướng dẫn giải
Giải thích các bước giải:
Cl2 + H2 ⟶ 2HCl
Cl2 + 2NaOH ⟶ NaCl + NaClO + H2O
H2O + Cl2 ⟶ HCl + HClO
vì các đáp án còn lại có O2, NaCl là ko tác dụng với Cl2
Ví dụ 9: Cho các phát biểu sau:
(a) Điện phân dung dịch NaCl (điện cực trơ), thu được khí H2 ở catot.
(b) Cho CO dư qua hỗn hợp Al2O3 và CuO đun nóng, thu được Al và Cu.
(c) Nhúng thanh Zn vào dung dịch chứa CuSO4 và H2SO4, có xuất hiện ăn mòn điện hóa.
(d) Kim loại có nhiệt độ nóng chảy thấp nhất là Hg, kim loại dẫn điện tốt nhất là Ag.
(e) Cho dung dịch AgNO3 dư vào dung dịch FeCl2, thu được chất rắn gồm Ag và AgCl.
Số phát biểu đúng là
A. 4
B. 3
C. 2
D. 5
Đáp án A
Hướng dẫn giải
(a) đúng
2NaCl + 2H2O ⟶ 2NaOH + Cl2 (anot) + H2 (catot)
(b) Sai vì CO không khử được Al2O3
(c) đúng vì khi đó hình thành 2 cặp oxi hóa khử khác nhau là Zn2+/Zn và Cu2+/Cu cùng nhúng trong 1 dung dịch chất điện li là H2SO4=> hình thành ăn mòn điện hóa.
(d) đúng
(e) đúng, 3AgNO3 + FeCl2 → Fe(NO3)3 + 2AgCl↓ + Ag↓
=> có 4 phát biểu đúng
Ví dụ 10: Thực hiện các thí nghiệm sau:
(1) Cho Si vào dung dịch NaOH (dư).
(2) Điện phân dung dịch NaCl dư bằng điện cực trơ, không màng ngăn xốp.
(3) Cho khí H2S vào dung dịch chứa FeCl3.
(4) Dẫn luồng khí H2 qua ống sứ chứa CuO nung nóng.
(5) Cho bột Ni vào dung dịch FeCl3 dư.
Số thí nghiệm thu được đơn chất là
A. 5
B. 3
C. 2
D. 4
Đáp án D
Hướng dẫn giải
(1) Si + 2NaOH + H2O → Na2SiO3 + H2↑
(2) 2NaCl + H2O → NaCl + NaClO + H2
(3) H2S + 2FeCl3 → 2FeCl2 + 2HCl + S↓
(4) H2 + CuO ⟶ Cu↓ + H2O
(5) Ni + 2FeCl3 → NiCl2 + 2FeCl2
→ có 4 thí nghiệm thu được đơn chất
Ví dụ 11: Nhận định nào đúng về quá trình xảy ra ở cực âm và cực dương khi điện phân dung dịch NaCl và điện phân NaCl nóng chảy?
A. Ở catot đều là quá trình khử ion Na+, ở anot đều là quá trình oxi hóa ion Cl-
B. Ở catot đều là quá trình khử nước, ở anot đều là quá trình oxi hóa ion Cl-
C. Ở catot, điện pân dung dịch NaCl là quá trình khử nước, điện phân NaCl nóng chảy là quá trình khử ion Na+, ở anot đều có quá trình oxi hóa ion Cl-
D. Ở catot, điện phân dung dịch NaCl là quá trình khử ion Na+, điện phân NaCl nóng chảy là quá trình khử nước. Ở anot đều là quá trình oxi hóa ion Cl-
Đáp án C
Hướng dẫn giải
Điện phân dung dịch NaCl:
2NaCl + 2H2O → 2NaOH + Cl2 + H2
Điện phân NaCl nóng chảy:
2NaCl → 2Na + Cl2
→ ở catot, điện phân dung dịch NaCl là quá trình khử nước, điện phân NaCl nỏng chảy là quá trình khử ion Na+, ở anot đều có quá trình oxi hóa ion Cl-
Ví dụ 12: Hai dung dịch tác dụng với nhau, sản phẩm thu được có NaCl. Hãy cho biết hai cặp dung dịch các chất đã dùng ban đầu là
A. BaCl2 và NaOH.
B. MgCl2 và NaOH.
C. Na2SO4 và HCl.
D. NaNO3 và KCl.
Đáp án B
Hướng dẫn giải
Để thu được sản phẩm là NaCl => 2 chất ban đầu tác dụng với nhau, ngoài sản phẩm là NaCl thì chất còn lại là kết tủa hoặc chất khí hoặc H2O
=> 2 chất là MgCl2 và NaOH
Phương trình hóa học: MgCl2 + 2NaOH → Mg(OH)2 + 2NaCl
Ví dụ 13: Hoà tan 10,95 gam KNO3 vào 150 gam nước thì được dung dịch bão hoà ở 200C, độ tan của KNO3 ở nhiệt độ này là
A. 6,3 gam.
B. 7,0 gam
C. 7,3 gam
D. 7,5 gam
Đáp án C
Hướng dẫn giải
Độ tan (S) của một chất trong nước là số gam chất đó hòa tan trong 100 gam nước để tạo thành dung dịch bão hòa ở một nhiệt độ xác định.
150 gam nước hòa tan được 10,95 gam KNO3
100 gam nước hòa tan được S gam KNO3
=> độ tan S=100.10,95/150 = 7,3 gam
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.