Toptailieu.vn biên soạn và giới thiệu phương trình phản ứng 2KI + H2O2 → I2 + 2KOH | KI ra I2. Phản ứng 2KI + H2O2 → I2 + 2KOH | KI ra I2 thuộc loại phản ứng oxi hóa khử đã được cân bằng chính xác và chi tiết nhất. Bài viết giới thiệu các nội dung liên quan giúp học sinh nắm bắt kiến thức cơ bản. Mời các bạn đón đọc:
Nội dung bài viết
1. Phương trình phản ứng hóa học:
2KI + H2O2 → I2 + 2KOH
2. Hiện tượng nhận biết phản ứng
- sản phẩm sinh ra làm xanh hồ tinh bột.
3. Điều kiện phản ứng
- điều kiện thường.
4. Tính chất hóa học
- Kali iotua bị oxi hóa thành iod tự do bởi các chất oxi hóa mạnh như axit sunfuric đặc, kali pemanganat, khí clo:
4KI + 2CO2 + O2 → 2K2CO3 + 2I2
Phản ứng này dùng để phân tách iod từ khoáng chất thiên nhiên.
- Cũng giống như các muối iodua khác, KI tạo muối triiođua I3- khi xử lý với I2:
KI(l) + I2 (r) → KI3 (l)
- Potassium iodide cũng được sử dụng trong việc tráng phim:
KI(l) + AgNO3 (l) → AgI(r) + KNO3 (l)
- Phản ứng oxy hóa khử khi cho KI tác dụng với K2SO3.
2KI + SO3 → I2 + K2SO3
2KI + 2FeCl3 → 2FeCl2 + I2 + 2KCl
- Phương trình hóa học hữu cơ
KI + CH3CH(Br)CH2(Br) → KBr + IBr + CH2=CHCH3
5. Cách thực hiện phản ứng
- nhỏ H2O2 nguyên chất vào ống nghiệm chứa KI và vài giọt hồ tinh bột.
6. Bạn có biết
- H2O2: nước oxi già
7. Bài tập liên quan
Ví dụ 1: Chất nào sau không phản ứng với dung dịch KI?
A. FeCl3.
B. H2O2.
C. O3.
D. NaCl.
Hướng dẫn giải
NaCl không phản ứng.
Đáp án D.
Ví dụ 2: Cho H2O2 nguyên chất vào ống nghiệm đựng KI có chứa sẵn hồ tinh bột. Hiện tượng quan sát được là
A. Dung dịch hiện màu vàng nâu.
B. Dung dịch hiện màu xanh.
C. Dung dịch có màu trắng.
D. Có kết tủa màu vàng nhạt.
Hướng dẫn giải
2KI + H2O2 → I2 + 2KOH
I2 sinh ra làm xanh hồ tinh bột.
Đáp án B.
Ví dụ 3: Khối lượng Iot sinh ra khi cho H2O2 nguyên chất phản ứng vừa đủ với 0,01 mol KI là
A. 1,27g.
B. 12,7g.
C. 2,5g.
D. 25,4g.
Hướng dẫn giải
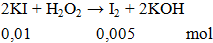
m = 0,005.254 = 1,27g.
Đáp án A.
Bài viết cùng bài học:




