Toptailieu.vn biên soạn và giới thiệu phương trình phản ứng 2KHCO3 + Ca(HSO4)2 → K2SO4 + CaSO4+ 2CO2 + 2H2O |KHCO3 ra K2SO4. Phản ứng 2KHCO3 + Ca(HSO4)2 → K2SO4 + CaSO4+ 2CO2 + 2H2O |KHCO3 ra K2SO4 thuộc loại phản ứng trao đổi đã được cân bằng chính xác và chi tiết nhất. Bài viết giới thiệu các nội dung liên quan giúp học sinh nắm bắt kiến thức cơ bản. Mời các bạn đón đọc:
1. Phương trình phản ứng hóa học:
2KHCO3 + Ca(HSO4)2 → K2SO4 + CaSO4+ 2CO2 + 2H2O
2. Hiện tượng nhận biết phản ứng
- Có khí không màu thoát ra.
3. Điều kiện phản ứng
- điều kiện thường,
4. Tính chất hóa học
- Muối cacbonat tan tác dụng được với dung dịch bazơ tạo thành bazơ mới và muối mới
KHCO3 + Ba(OH)2 → KOH + BaCO3
- KHCO3 bền ở nhiệt độ thường, đun nóng bị phân hủy tạo muối trung hòa K2CO3:
2KHCO3 -to→ K2CO3 + H20+CO2
- Ngay trong dung dịch và ở nhiệt độ thường nó cũng bị phân hủy chậm tạo khí CO2; nếu đun nóng thì phân hủy sẽ mãnh liệt hơn.
- Tan trong nước thủy phân cho môi trường kiềm yếu → nhận biết được bằng quỳ tím chuyển xanh và metyl da cam chuyển vàng nhưng không nhận biêt được bằng phenolphthalein:
KHCO3 + H2O ⇄ K2CO3 + KOH
- Tác dụng với dung dịch kiềm (NaOH, KOH…) → phản ứng trung hòa.
KHCO3 + KOH → K2CO3 + H2O
2KHCO3 + Ca(OH )2 → K2CO3 + CaCO3 + H2O
KHCO3 + Ca(OH)2 → KOH + CaCO3 + H2O
- Phản ứng của 2 muối axit với nhau: (muối axit mạnh sẽ đóng vai trò là axit; muối axit yếu sẽ đóng vài trò là bazơ)
KHSO4 + KHCO3 → K2SO4 + CO2 + H2O
- Tác dụng với axit: (muối của axit yếu phản ứng với axit mạnh tạo ra muối mới + axit yếu hơn)
HCl + KHCO3 → KCl + CO2 + H2O
H2SO4 + 2KHCO3 → K2SO4 + 2CO2 + 2H2O
- Tác dụng với muối:
KHCO3 + AlCl3 + H2O → KCl + CO2 + Al(OH)3
KHCO3 + FeCl3 + H2O → Fe(OH)3 + KCl + CO2
KHCO3 + BaCl2 -to→ BaCO3 + KCl + H2O
- Tác dụng với oxit axit:
KHCO3 + SO2 → KHSO3 + CO2
5. Cách thực hiện phản ứng
- Nhỏ Ca(HSO4)2 vào ống nghiệm chứa KHCO3.
6. Bạn có biết
- KHCO3 phản ứng với các muối hidro sunfat đều giải phóng khí.
7. Bài tập liên quan
Ví dụ 1: Nhỏ Ca(HSO4)2 vào ống nghiệm chứa KHCO3 thu được hiện tượng là
A. Có khí không màu thoát ra.
B. Có khí màu nâu đỏ thoát ra.
C. Có khí màu vàng lục thoát ra.
D. Không có hiện tượng gì.
Hướng dẫn giải
2KHCO3 + Ca(HSO4)2 → K2SO4 + CaSO4+ 2CO2 + 2H2O
CO2: khí không màu.
Đáp án A.
Ví dụ 2: Thể tích khí ở dktc thoát ra khi cho 10g KHCO3 phản ứng hoàn toàn với lượng dư Ca(HSO4)2 là
A. 1,12 lít.
B. 2,24 lít.
C. 3,36 lít.
D. 4,48 lít.
Hướng dẫn giải
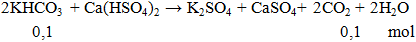
V = 0,1.22,4 = 2,24 lít.
Đáp án B.
Ví dụ 3: Cho 1g KHCO3 phản ứng hoàn toàn với lượng Ca(HSO4)2, khối lượng muối thu được sau phản ứng là
A. 1,55 gam.
B. 1,74 gam.
C. 0,47 gam.
D. 0,87 gam.
Hướng dẫn giải
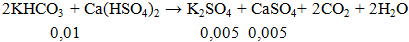
Khối lượng kết tủa = 0,005.(174+ 136)= 1,55gam.
Đáp án A.
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.