Toptailieu.vn biên soạn và giới thiệu phương trình phản ứng Na2CO3 + 2HCl → 2NaCl + CO2 ↑ + H2O | Na2CO3 ra NaCl. Phản ứng Na2CO3 + 2HCl → 2NaCl + CO2 ↑ + H2O | Na2CO3 ra NaCl thuộc loại phản ứng trao đổi đã được cân bằng chính xác và chi tiết nhất. Bài viết giới thiệu các nội dung liên quan giúp học sinh nắm bắt kiến thức cơ bản. Mời các bạn đón đọc:
Nội dung bài viết
1. Phương trình phản ứng hóa học:
Na2CO3 + 2HCl → 2NaCl + CO2 ↑ + H2O
2. Hiện tượng nhận biết phản ứng
- Có khí không màu thoát ra.
3. Điều kiện phản ứng
- điều kiện thường,
4. Bản chất của các chất tham gia phản ứng
a. Bản chất của Na2CO3 (Natri cacbonat)
Na2CO3 là chất lưỡng tính tác dụng được cả axit và bazơ, khi Na2CO3 tác dụng với axit mạnh sẽ tạo thành muối và nước giải phóng khí CO2.
b. Bản chất của HCl (Axit clohidric)
HCl là một axit mạnh tác dụng được với chất có tính bazo.
5. Tính chất hóa học
Khi Axit dư thì
Na2CO3 + NaOH → NaCO3 + Na2OH
Na2CO3 + CaCl2 → 2NaCl + CaCO3
Na2CO3 + CO2 + H2O = 2NaCl + CaCO3
Ngoài ra hóa chất này không bị nhiệt phân hủy ở nhiệt độ cao và làm quỳ tím chuyển sang màu xanh
- Axit HCl làm đổi màu quỳ tím: Khi nhúng quỳ tím vào dung dịch axit sẽ có hiện tượng quỳ tím chuyển đỏ.
- Axit clohidric tác dụng với kim loại đứng trước H, tạo thành muối và hidro
Fe + 2HCl → FeCl2 + H2↑
- Axit clohidric tác dụng với oxit kim loại, tạo thành muối Clorua và nước
6HCl + Al2O3 →2AlCl3 + 3H2O
- Axit clohidric tác dụng với Bazơ, tạo thành muối Clorua và nước
3HCl + Al(OH)3 → AlCl3 + 3H2O
- Axit clohidric tác dụng với muối, tạo thành muối mới và axit mới
AgNO3 + 2HCl → AgCl↓ + HNO3
- Axit clohidric tác dụng với hợp chất có tính oxi hoá, thể hiện tính khử
6HCl + KClO3 → KCl + 3Cl2↑ + 3H2O
Lưu ý: Axit HCl sẽ không tác dụng với những kim loại đứng sau H trong dãy điện hoá, không tác dụng với các phi kim, axit, oxit kim loại, oxit phi kim.
6. Cách thực hiện phản ứng
- Nhỏ HCl vào ống nghiệm chứa Na2CO3.
7. Bạn có biết
- Na2CO3 phản ứng với các axit như H2SO4, HBr… đều giải phóng khí.
8. Bài tập liên quan
Ví dụ 1: Nhỏ HCl vào ống nghiệm chứa Na2CO3 thu được hiện tượng là
A. Có khí không màu thoát ra.
B. Có khí màu nâu đỏ thoát ra.
C. Có khí màu vàng lục, mùi xốc thoát ra.
D. Không có hiện tượng gì.
Hướng dẫn giải
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
CO2: khí không màu
Đáp án A.
Ví dụ 2: Thể tích khí ở dktc thoát ra khi cho 10,6g Na2CO3 phản ứng hoàn toàn với lượng dư HCl là
A. 1,12 lít.
B. 2,24 lít.
C. 3,36 lít.
D. 4,48 lít.
Hướng dẫn giải
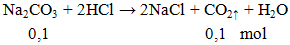
V = 0,1.22,4 = 2,24 lít.
Đáp án B.
Ví dụ 3: Cho 1,06g Na2CO3 phản ứng hoàn toàn với lượng HCl, khối lượng muối có trong dung dịch thu được sau phản ứng là
A. 1,17 gam.
B. 0,745 gam.
C. 0,475 gam.
D. 1,49 gam.
Hướng dẫn giải
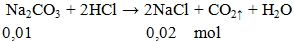
khối lượng muối = 0,02.58,5 = 1,17 gam.
Đáp án A.
Ví dụ 4: Nhận định nào sau đây về muối nitrat là đúng?
A. Tất cả các muối nitrat đều tan trong nước.
B. Tất cả các muối nitrat đều bị nhiệt phân tạo ra oxit kim loại và nito dioxit.
C. Tất cả các muối nitrat đều bị nhiệt phân trừ muối nitrat của kim loại kiềm.
D. Tất cả các muối nitrat đều không tan trong nước.
Đáp án A
Hướng dẫn giải
Nhận định về muối nitrat là đúng là: Tất cả các muối nitrat đều tan trong nước.
Ví dụ 5: Phản ứng sản xuất vôi: CaCO3(r) → CaO(r) + CO2(k); ΔH > 0 .
Biện pháp kĩ thuật tác động vào quá trình sản xuất vôi để tăng hiệu suất phản ứng là
A. giảm nhiệt độ.
B. tăng nhiệt độ và giảm áp suất khí CO2.
C. tăng áp suất.
D. giảm nhiệt độ và tăng áp suất khí CO2.
Đáp án B
Hướng dẫn giải
Chiều thuận ( ∆H > 0):phản ứng thu nhiệt → tăng nhiệt độ cân bằng chuyển dịch theo chiều thuận
Giảm áp suất khí CO2 → Cân bằng chuyển dịch theo hướng tăng áp suất của hệ tức theo chiều thuận
Ví dụ 6: Nhóm các kim loại nào sau đây đều tác dụng được với nước tạo dung dịch kiềm:
A. Na, K, Mg, Ca.
B. Fe, Mg, Ca, Ba.
C. Ba, Na, K, Ca.
D. K, Na, Ca, Cu.
Đáp án C
Hướng dẫn giải
Phương trình phản ứng minh họa
Ba + 2H2O → Ba(OH)2 + H2
Na + H2O → NaOH + 1/2H2
K + H2O → KOH + 1/2H2
Ca + 2H2O → Ca(OH)2 + H2
Ví dụ 7: Muối NaHCO3 không thể tham gia phản ứng nào sau đây
A. Tác dụng với axit
B. Tác dụng với kiềm
C. Tác dụng nhiệt, bị nhiệt phân
D. Tác dụng với dung dịch Ba(NO3)2.
Đáp án D
Hướng dẫn giải
A. Tác dụng với axit
NaHCO3 + HCl → NaCl + CO2+ H2O
B. Tác dụng với kiềm
NaHCO3 + NaOH → Na2CO3 + H2O
C. Tác dụng nhiệt, bị nhiệt phân
2NaHCO3 → Na2CO3 + CO2 + H2O
D. NaHCO3 không Tác dụng với dung dịch Ba(NO3)2.
Ví dụ 8: Hỗn hợp R gồm 2 kim loại X và Y thuộc phân nhóm chính nhóm II, ở 2 chu kỳ liên tiếp. Cho 3,52 gam R tan hoàn toàn trong dung dịch HCl dư thu được 2,688 lít khí H2 (đktc). Cô cạn dung dịch sau phản ứng, khối lượng muối khan thu được là
A. 12,04 gam
B. 3,98 gam
C. 5,68 gam
D. 7,2 gam
Đáp án A
Hướng dẫn giải
Phương trình phản ứng: R + 2HCl → RCl2 + H2
Ta có nHCl = 2nH2 = 0,24 mol
mmuối = mkim loại+ mCl- = 3,52 + 0,24. 35,5 = 12,04 gam.
Ví dụ 9: Hấp thụ hoàn toàn 0,784 lít CO2 (đktc) vào 500ml dung dịch NaOH 0,08 M thu được dung dịch X. Thêm 250 ml dung dich Y gồm BaCl2 0,08 M và Ba(OH)2 a mol/l vào dung dịch X thu được 1,97 gam kết tủa và dung dịch Z. Tính a?
A. 0,02 M
B. 0,04 M
C. 0,03M
D. 0,015 M
Đáp án B
Hướng dẫn giải
nCO2 = 0,035 mol; nNaOH = 0,04 mol
⇒ nNa2CO3 = 0,005 mol; nNaHCO3 = 0,03 mol
⇒ nBaCO3 = 0,01 mol < nBaCl2 = 0,02 mol ⇒ nCO32- = nBaCO3 = 0,01 mol
OH- + HCO3- → CO32-
nOH- = nCO32- = 0,01 mol ⇒ a = 0,005/0,125 = 0,04 mol
Ví dụ 10: Khi cắt miếng Na kim loại, bề mặt vừa cắt có ánh kim lập tức mờ đi, đó là do có sự hình thành các sản phẩm rắn nào sau đây?
A. Na2O, NaOH, Na2CO3, NaHCO3.
B. NaOH, Na2CO3, NaHCO3.
C. Na2O, Na2CO3, NaHCO3.
D. Na2O, NaOH, Na2CO3.
Đáp án A
Hướng dẫn giải
Do hàm lượng H2O và CO2 trong không khí khá nhiều:
H2O sễ chuyển Na → NaOH từ đó tác dụng với CO2
Na + H2O → NaOH + 1/2H2
2NaOH + CO2 → Na2CO3 + H2O
Na2CO3 + H2O + CO2 → 2NaHCO3
Ví dụ 11: Để điều chế kim loại Na, người ta thực hiện phản ứng:
A. Điện phân dung dịch NaOH.
B. Điện phân nóng chảy NaCl hoặc NaOH .
C. Cho dung dịch NaOH tác dụng với dung dịch HCl.
D. Cho dung dịch NaOH tác dụng với H2O.
Đáp án B
Hướng dẫn giải
Điện phân nóng chảy NaCl hoặc NaOH .
Khi điện phân NaOH nóng chảy thì ở catot (-) xảy ra quá trình khử Na+ thành Na, ở anot (+) xảy ra quá trình oxi hóa OH- thành O2 và H2O
4NaOH → 4Na + O2+ 2H2O
Ví dụ 12: Cho các dung dịch sau: KOH; KHCO3; K2CO3; KHSO4; K2SO4, CH3COOK. Dung dịch làm cho quỳ tím đổi màu xanh là:
A. KOH; K2SO4; Na2CO3, CH3COOK
B. KHSO4; KHCO3; K2CO3.
C. KOH; KHCO3; K2CO3.
D. KHSO4; KOH; KHCO3, CH3COOK
Đáp án C
Hướng dẫn giải
Dung dịch làm cho quỳ tím đổi màu xanh là: KHSO4; KOH; KHCO3, CH3COOK
Loại A vì K2SO4; Na2CO3 là muối trung tính
Loại B. KHSO4; KHCO3; K2CO3.
Loại D. KHSO4; KOH; KHCO3, CH3COOK
Ví dụ 13: Nhỏ từ từ từng giọt đến hết 30 ml dung dịch HCl 1M vào 100 ml dung dịch chứa K2CO3 0,2M và KHCO3 0,2M, sau phản ứng thu được số mol CO2 là
A. 0,02.
B. 0,03.
C. 0,04.
D. 0,01.
Đáp án D
Hướng dẫn giải
Nhỏ từ từ HCl vào dung dịch thứ tự phản ứng:
H+ + CO32- → HCO3- (1)
H+ + HCO3- → CO2 + H2O (2)
nH+ = 0,03 mol
nCO32- = 0,02 mol < nH+
nH+ (2) = nCO2= 0,03 - 0,02 = 0,01 mol
Ví dụ 14: Khi cho từ từ dung dịch HCl vào dung dịch Na2CO3 khuấy đều, hiện tượng xảy ra là
A. xuất hiện chất khí bay ra ngay khi cho HCl vào
B. sau 1 thời gian thấy xuất hiện chất khí bay ra, dung dịch trong suốt
C. không có khí thoát ra
D. có khí thoát ra và xuất hiện kết tủa
Đáp án B
Hướng dẫn giải
Khi cho từ từ dung dịch HCl vào dung dịch Na2CO3 khuấy đều, hiện tượng xảy ra là sau 1 thời gian thấy xuất hiện chất khí bay ra, dung dịch trong suốt
Na2CO3 + 2HCl → 2NaCl + CO2+ H2O
Ví dụ 15: Sản phẩm tạo thành có chất kết tủa khi dung dịch Na2CO3 tác dụng với dung dịch
A. NaCl.
B. BaCl2.
C. KOH.
D. KNO3.
Đáp án B
Hướng dẫn giải
Sản phẩm tạo thành có chất kết tủa khi dung dịch Na2CO3tác dụng với dung dịch là BaCl2
Phương trình phản ứng hóa học
Na2CO3 + BaCl2 → 2NaCl + BaCO3
BaCO3 là kết tủa màu trắng
Ví dụ 16: Sản phẩm tạo thành có chất kết tủa khi dung dịch Na2CO3 tác dụng với dung dịch
A. KCl.
B. CaCl2.
C. KOH.
D. NaNO3.
Đáp án B
Hướng dẫn giải
Sản phẩm tạo thành có chất kết tủa khi dung dịch Na2CO3 tác dụng với dung dịch là CaCl2
Phương trình phản ứng hóa học
Na2CO3 + CaCl2 → 2NaCl + CaCO3
CaCO3 là kết tủa màu trắng
Ví dụ 17: Cho các chất sau: Al, CO2, FeCl2, KHCO3, CuSO4, MgCl2. Số chất phản ứng với dung dịch KOH loãng nóng là
A. 4
B. 5
C. 3
D. 6
Đáp án D
Hướng dẫn giải
Các chất pư được với dung dịch KOH loãng nóng là: Al, CO2, FeCl2, KHCO3, CuSO4, MgCl2 → cả 6 chất
Phương trình hóa học minh họa
Al + KOH + H2O → KAlO2 + 3/2 H2O
CO2 + KOH → KHCO3 hoặc CO2 + 2KOH → K2CO3 + H2O
FeCl2 + 2KOH → Fe(OH)2↓ + 2KCl
KHCO3 + KOH → K2CO3 + H2O
CuSO4 + 2KOH → Cu(OH)2↓ + K2SO4
MgCl2 + 2KOH → Mg(OH)2↓ + KCl
Ví dụ 18: Cho các chất sau: FeS, FeS2, FeO, Fe2O3, Fe(OH)2, FeCO3, FeSO3, Fe(OH)3, FeSO4. Có bao nhiêu chất khi cho tác dụng với H2SO4 đặc, nóng có khí SO2 thoát ra?
A. 9
B. 6
C. 7
D. 8
Đáp án C
Hướng dẫn giải
Các chất khi cho tác dụng với H2SO4 đặc, nóng có khí SO2 thoát ra là: FeS, FeS2, FeO, Fe(OH)2, FeCO3, FeSO3, FeSO4
Phương trình phản ứng minh họa
2FeS + 10H2SO4 → Fe2(SO4)3+ 9SO2 + 10H2O
2FeS2 + 14H2SO4 → Fe2(SO4)3 + 15SO2 + 14H2O
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2↑ + 4H2O
8Fe(OH)2 + 13H2SO4 → 4Fe2(SO4)3 + H2S + 20H2O
4H2SO4 + 2 FeSO3 → Fe2(SO4)3 + 3 SO2 + 4 H2O
2FeSO4 + 2H2SO4 → Fe2(SO4)3 + SO2 + 2H2OVí dụ 19: Cho các mệnh đề sau:
1) Các muối nitrat đều tan trong nước và đều là chất điện li mạnh.
2) Ion NO3- có tính oxi hóa trong môi trường axit.
3) Khi nhiệt phân muối nitrat rắn ta đều thu được khí NO2.
4) Hầu hết muối nitrat đều bền nhiệt.
Các mệnh đề đúng là:
A.(1), (2), (3).
B.(2) và (4).
C.(2) và (3).
D.(1) và (2).
Đáp án D
Hướng dẫn giải
Các mệnh đề đúng là: (1) và (2)
(3) sai vì muối nitrat của K, Na, Ba, Ca nhiệt phân không thu được khí NO2
(4) sai vì các muối nitrat hầu hết kém bền nhiệt
Ví dụ 20: Cặp chất nào dưới đây có phản ứng
A. H2SO4 và KHCO3.
B. MgCO3 và HCl.
C. Ba(OH)2và K2CO3.
D. NaCl và K2CO3.
Đáp án D
Hướng dẫn giải
Điều kiện xảy ra phản ứng trao đổi trong dung dịch của các chất chỉ xảy ra nếu sản phẩm tạo thành nếu có chất không tan hoặc chất khí.
Ba(OH)2 + K2CO3 → BaCO3↓ + 2KOH
MgCO3 + HCl → MgCl2 + CO2 ↑ + H2O
NaCl + K2CO3 không xảy ra phản ứng
H2SO4 + 2KHCO3 → K2SO4+ 2CO2 ↑ + 2H2O
Vậy cặp chất không xảy ra phản ứng là: NaCl và K2CO3.
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.