Toptailieu.vn biên soạn và giới thiệu phương trình phản ứng Na2CO3 + Ca(NO3)2 → 2NaNO3 + CaCO3(↓) | Na2CO3 ra NaNO3. Phản ứng Na2CO3 + Ca(NO3)2 → 2NaNO3 + CaCO3(↓) | Na2CO3 ra NaNO3 thuộc loại phản ứng trao đổi đã được cân bằng chính xác và chi tiết nhất. Bài viết giới thiệu các nội dung liên quan giúp học sinh nắm bắt kiến thức cơ bản. Mời các bạn đón đọc:
Nội dung bài viết
1. Phương trình phản ứng hóa học:
Na2CO3 + Ca(NO3)2 → 2NaNO3 + CaCO3(↓)
2. Hiện tượng nhận biết phản ứng
- Có kết tủa trắng.
3. Điều kiện phản ứng
- điều kiện thường.
4. Tính chất hóa học
Khi Axit dư thì
Na2CO3 + NaOH → NaCO3 + Na2OH
Na2CO3 + CaCl2 → 2NaCl + CaCO3
Na2CO3 + CO2 + H2O = 2NaCl + CaCO3
Ngoài ra hóa chất này không bị nhiệt phân hủy ở nhiệt độ cao và làm quỳ tím chuyển sang màu xanh
5. Cách thực hiện phản ứng
- nhỏ dung dịch Na2CO3 vào ống nghiệm chứa Ca(NO3)2
6. Bạn có biết
- Các dung dịch muối của Canxi va Canxi hidroxit cũng phản ứng với Na2CO3 tạo kết tủa.
7. Bài tập liên quan
Ví dụ 1: Nhỏ từ từ một vài giọt Na2CO3 vào ống nghiệm có chứa chất nào sau đây không thu được kết tủa có màu trắng?
A. BaCl2.
B. Ca(NO3)2.
C. AlCl3.
D. FeCl3.
Hướng dẫn giải
2FeCl3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓nâu đỏ + 3CO2 + 6NaCl
Đáp án D.
Ví dụ 2: Chất nào sau đây không thể phản ứng với Na2CO3?
A. CaCl2.
B. Ba(OH)2.
C. Ca(NO3)2.
D. BaSO4.
Hướng dẫn giải
BaSO4 không phản ứng với Na2CO3.
Đáp án D.
Ví dụ 3: Cho Na2CO3 phản ứng vừa đủ với 100ml Ca(NO3)2 aM, thấy thu được 1g kết tủa. Giá trị của a là
A. 0,1.
B. 0,2.
C. 0,5.
D. 0,25.
Hướng dẫn giải
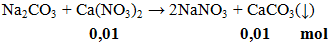
a = 0,01 : 0,1 = 0,1M.
Đáp án A.
Bài viết cùng bài học:




