Toptailieu.vn biên soạn và giới thiệu phương trình phản ứng 2NaI + O3 + H2O → 2NaOH + I2 + O2↑ | NaI ra NaOH. Phản ứng 2NaI + O3 + H2O → 2NaOH + I2 + O2↑ | NaI ra NaOH thuộc loại phản ứng oxi hóa khử đã được cân bằng chính xác và chi tiết nhất. Bài viết giới thiệu các nội dung liên quan giúp học sinh nắm bắt kiến thức cơ bản. Mời các bạn đón đọc:
Nội dung bài viết
1. Phương trình phản ứng hóa học:
2NaI + O3 + H2O → 2NaOH + I2 + O2↑
2. Hiện tượng nhận biết phản ứng
- sản phẩm sinh ra làm xanh hồ tinh bột.
3. Điều kiện phản ứng
- điều kiện thường.
4. Tính chất hóa học
- Natri iodide phản ứng với axit sulphuric dẫn đến sự hình thành hydro iodide và natri bisulfit. Phương trình hóa học được đưa ra dưới đây.
NaI + H2SO4 → HI + NaHSO4
- Natri iốt phản ứng với clo, trong đó clo thay thế iốt tạo thành natri clorua và iốt. Phương trình hóa học được đưa ra dưới đây.
Cl2 + 2NaI → 2 NaCl + I2
5. Cách thực hiện phản ứng
- dẫn khí O3 vào ống nghiệm chứa NaI và vài giọt hồ tinh bột.
6. Bạn có biết
- Phản ứng này chứng minh ozon có tính oxi hóa mạnh hơn oxi.
7. Bài tập liên quan
Ví dụ 1: Phản ứng nào chứng minh ozon có tính oxi hóa mạnh hơn oxi?
A. Lần lượt đốt cháy C trong oxi và ozon.
B. Cho oxi, ozon phản ứng với nước.
C. cho ozon vào dung dịch NaI có sẵn vài giọt hồ tinh bột.
D. Cho ozon, oxi phản ứng với Au.
Hướng dẫn giải
2NaI + O3 + H2O → 2NaOH + I2 + O2↑
Đáp án C.
Ví dụ 2: Cho ozon vào bình đựng NaI có chứa sẵn hồ tinh bột. Hiện tượng quan sát được là
A. Dung dịch hiện màu vàng nâu.
B. Dung dịch hiện màu xanh.
C. Dung dịch có màu trắng.
D. Có kết tủa màu vàng nhạt.
Hướng dẫn giải
2NaI + O3 + H2O → 2NaOH + I2 + O2↑
I2 sinh ra làm xanh hồ tinh bột.
Đáp án B.
Ví dụ 3: Thể tích khí O2 ở đktc sinh ra khi cho ozon phản ứng vừa đủ với 0,1 mol NaI là
A. 1,12 lít.
B. 2,24 lít.
C. 3,36 lít.
D. 4,48 lít.
Hướng dẫn giải
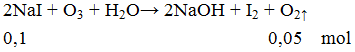
V = 0,05.22,4 = 1,12 lít.
Đáp án A.
Bài viết cùng bài học:




