Toptailieu.vn biên soạn và giới thiệu phương trình phản ứng 6NaOH + 3Cl2 -90oC→ 5NaCl + NaClO3 + 3H2O | NaOH ra NaCl. Phản ứng 6NaOH + 3Cl2 -90oC→ 5NaCl + NaClO3 + 3H2O | NaOH ra NaCl thuộc loại phản ứng oxi hóa khử đã được cân bằng chính xác và chi tiết nhất. Bài viết giới thiệu các nội dung liên quan giúp học sinh nắm bắt kiến thức cơ bản. Mời các bạn đón đọc:
Nội dung bài viết
1. Phương trình phản ứng hóa học:
6NaOH + 3Cl2 -90oC→ 5NaCl + NaClO3 + 3H2O
2. Hiện tượng nhận biết phản ứng
- Ban đầu mẩu quỳ có màu xanh, sau khi phản ứng xảy ra màu xanh của quỳ bị mất.
3. Điều kiện phản ứng
Phản ứng xảy ra ở khoảng 900C.
4. Tính chất hóa học
NaOH Là một bazơ mạnh nó sẽ làm quỳ tím chuyển màu xanh, còn dung dịch phenolphtalein thành màu hồng. Một số phản ứng đặc trưng của Natri Hidroxit được liệt kê ngay dưới đây.
Phản ứng với axit tạo thành muối + nước:
NaOHdd + HCldd→ NaCldd + H2O
Phản ứng với oxit axit: SO2, CO2…
2 NaOH + SO2→ Na2SO3 + H2O
NaOH + SO2→ NaHSO3
Phản ứng với muối tạo bazo mới + muối mới (điều kiện: sau phản ứng phải tạo thành chất kết tủa hoặc bay hơi):
2 NaOH + CuCl2→ 2NaCl + Cu(OH)2↓
Tác dụng với kim loại lưỡng tính:
2 NaOH + 2Al + 2H2O→ 2NaAlO2 + 3H2↑
2NaOH + Zn → Na2ZnO2 + H2↑
Tác dụng với hợp chất lưỡng tính:
NaOH + Al(OH)3 → NaAl(OH)4
2NaOH + Al2O3 → 2NaAlO2 + H2O
5. Cách thực hiện phản ứng
- Dẫn khí Cl2 vào ống nghiệm chứa dung dịch NaOH đun nóng và mẩu quỳ tím.
6. Bạn có biết
- Tương tự NaOH, Clo có thể phản ứng với các dung dịch kiềm ở nhiệt độ cao cho muối clorat.
7. Bài tập liên quan
Ví dụ 1: NaOH không thể phản ứng với khí nào sau ở điều kiện thường?
A. SO2.
B. CO2.
C. Cl2.
D. H2.
Hướng dẫn giải
NaOH không thể phản ứng với H2.
Đáp án D.
Ví dụ 2: Cho Clo phản ứng vừa đủ với NaOH ở 900C, dung dịch thu được có chứa các chất nào sau đây?
A, NaCl và NaClO.
B. NaClO.
C. NaCl và NaClO3.
D. NaCl.
Hướng dẫn giải
6NaOH + 3Cl2 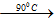 5NaCl + NaClO3 + 3H2O
5NaCl + NaClO3 + 3H2O
Đáp án C.
Ví dụ 3: Thể tichs khí clo ở đktc cần dung để phản ứng vừa đủ với 100ml NaOH 1M ở 900C là
A. 1,12 lít.
B. 2,24 lít.
C. 3,36 lít.
D. 4,48 lít.
Hướng dẫn giải
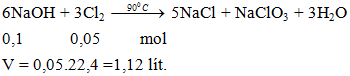
Đáp án A.
Bài viết cùng bài học:




