Toptailieu.vn biên soạn và giới thiệu phương trình phản ứng Mg + S → MgS | Mg ra MgS. Phản ứng Mg + S → MgS | Mg ra MgS thuộc loại phản ứng oxi hóa khử, phản ứng hóa hợp đã được cân bằng chính xác và chi tiết nhất. Bài viết giới thiệu các nội dung liên quan giúp học sinh nắm bắt kiến thức cơ bản. Mời các bạn đón đọc:
1. Phương trình phản ứng hóa học:
Mg + S → MgS
2. Hiện tượng nhận biết phản ứng
Khi đốt nóng hỗn hợp, lưu huỳnh nóng chảy, hỗn hợp cháy sáng và bắt đầu chuyển thành hợp chất màu trắng.
3. Điều kiện phản ứng
Nhiệt độ cao
4. Tính chất hóa học
- Magie là chất khử mạnh:
Mg → Mg2+ + 2e
a. Tác dụng với phi kim
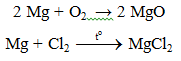
Lưu ý:
- Do Mg có ái lực lớn với oxi: 2Mg + CO2 → MgO. Vì vậy không dùng tuyết cacbonic để dập tắt đám cháy Mg.
b. Tác dụng với axit
- Với dung dịch HCl và H2SO4 loãng:
Mg + H2SO4 → MgSO4 + H2
- Với dung dịch HNO3:
4Mg + 10 HNO3 → 4 Mg(NO3)2 + NH4NO3 + 3 H2O
5. Cách thực hiện phản ứng
Cho kim loại magie tác dụng với bột lưu huỳnh rồi đốt nóng hỗn hợp.
6. Bạn có biết
Mg tác dụng với S nung nóng thu được hợp chất MgS màu đen. Hợp chất bị thủy phân trong nước và tan trong axit.
7. Bài tập liên quan
Ví dụ 1: Đun nóng 4,8 gam bột Mg với 9,6 gam bột lưu huỳnh (trong điều kiện không có không khí), thu được chất rắn X. Cho toàn bộ X vào lượng dư dung dịch HCl, thu được V lít khí (đktc). Giá trị của V là
A. 2,24 lít
B. 3,36 lít
C. 4,48 lít
D. 6,72 lít
Hướng dẫn giải:
Đáp án C
Phương trình phản ứng: Mg + S → MgS
nMg = 4,8/24 = 0,2 (mol); nS = 9,6/32 = 0,3 (mol) ⇒ S dư; nMgS = 0,2 (mol)
MgS + 2HCl → MgCl2 + H2S ↑
⇒ V = 0,2.22,4 = 4,48 (lít)
Ví dụ 2: Đun nóng 2,4 g Mg với 4,8 g bột lưu huỳnh (trong điều kiện không có không khí) thu được muối X. Khối lượng muối X thu được là:
A. 0,56 g
B. 5,6 g
C. 0,28 g
D. 2,8 g
Hướng dẫn giải:
Đáp án B
Phương trình phản ứng: Mg + S → MgS
nMg = 0,1 (mol); nS = 4,8/32 = 0,15 (mol) ⇒ S dư; nMgS = 0,1 (mol)
mMgS = 0,1.56 = 5,6 g
Ví dụ 3: Đun nóng 2,4 gam bột Mg với bột lưu huỳnh dư (trong điều kiện không có không khí), thu được chất rắn X. Cho toàn bộ X vào lượng dư dung dịch H2SO4, thu được V lít khí (đktc). Giá trị của V là
A. 2,24 lít
B. 3,36 lít
C. 4,48 lít
D. 6,72 lít
Hướng dẫn giải:
Đáp án A
Phương trình phản ứng: Mg + S → MgS
nMg = 2,4/24 = 0,1 (mol); S dư; nMgS = 0,1 (mol)
MgS + H2SO4 → MgSO4 + h2S ↑
⇒ V = 0,1.22,4 = 2,24 (lít)
Bài viết cùng bài học:




