Toptailieu.vn biên soạn và giới thiệu phương trình phản ứng Mg + 2H2SO4 → MgSO4 + H2 | Mg ra MgSO4. Phản ứng Mg + 2H2SO4 → MgSO4 + H2 | Mg ra MgSO4 thuộc loại phản ứng oxi hóa khử, phản ứng thế đã được cân bằng chính xác và chi tiết nhất. Bài viết giới thiệu các nội dung liên quan giúp học sinh nắm bắt kiến thức cơ bản. Mời các bạn đón đọc:
1. Phương trình phản ứng hóa học:
Mg + H2SO4 → MgSO4 + H2
2. Hiện tượng nhận biết phản ứng
Kim loại tan dần tạo thành dung dịch không màu đồng thời xuất hiện bọt khí thoát ra.
3. Điều kiện phản ứng
Nhiệt độ thường, H2SO4 loãng
4. Bản chất của các chất tham gia phản ứng
a. Bản chất của Mg (Magie)
Mg là chất khử mạnh tác dụng với axit HCl, HNO3, H2SO4,..
b. Bản chất của H2SO4 (Axit sunfuric)
Axit sunfuric ở dạng loãng là một axit mạnh có đầy đủ tính chất thường gặp của một axit nên tác dụng với kim loại đứng trước H (trừ Pb) tạo thành muối sunfat.
5. Tính chất hóa học
5.1. Tính chất hóa học của Magie (Mg)
- Magie là chất khử mạnh:
Mg → Mg2+ + 2e
a. Tác dụng với phi kim
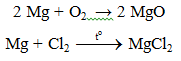
Lưu ý:
- Do Mg có ái lực lớn với oxi: 2Mg + CO2 → MgO. Vì vậy không dùng tuyết cacbonic để dập tắt đám cháy Mg.
b. Tác dụng với axit
- Với dung dịch HCl và H2SO4 loãng:
Mg + H2SO4 → MgSO4 + H2
- Với dung dịch HNO3:
4Mg + 10 HNO3 → 4 Mg(NO3)2 + NH4NO3 + 3 H2O
5.2. Tính chất hóa học của Axit sunfuric (H2SO4)
Axit sunfuric đặc có tính axit mạnh, oxi hóa mạnh với tính chất hóa học nổi bật như:
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
C + 2H2SO4 → CO2 + 2H2O + 2SO2 (nhiệt độ)
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
C12H22O11 + H2SO4 → 12C + H2SO4.11H2O
6. Cách thực hiện phản ứng
Cho Mg tác dụng với dung dịch axit sunfuric loãng thu được muối magiesunfat
7. Bạn có biết
Kim loại tan dần tạo thành dung dịch không màu đồng thời xuất hiện bọt khí thoát ra.
8. Bài tập liên quan
Ví dụ 1: Phương trình hoá học nào sau đây sai?
A. Mg + H2SO4 → MgSO4 + H2
B. Al(OH)3 + 3HCl → AlCl3 +3H2O
C. FeO + 2HNO3 → Fe(NO3)2 + H2O
D. 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Hướng dẫn giải:
Đáp án C
3FeO + 10HNO3 → 3Fe(NO3)3 + 5H2O + NO2
Ví dụ 2: Cho kim loại X hóa trị II tác dụng vừa đủ với 3,2 g S đun nóng thu được 5,6 g muối. Kim loại X là:
A. Zn
B. Cu
C. Mg
D. Al
Hướng dẫn giải:
Đáp án C
Phương trình phản ứng : X + S → XS
nX = nS = 0,1 mol
Ta có: MX = (5,6-3,2)/0,1 = 24 ⇒ X là Mg
Ví dụ 3: Cho 6,4g hỗn hợp 2 kim loại Mg và Cu tác dụng với bột S dư trong điều kiện không có không khí thu được m g muối. Cho muối tác dụng với dung dịch H2SO4 loãng dư thu được 2,24 lít khí. Giá trị của m là
A. 8g
B. 9,6g
C. 16g
D. 1,6 g
Hướng dẫn giải:
Đáp án C
n SO42- = nH2S = 0,1 mol
mmuối = mKL + mSO42- = 6,4 + 0,1.96 = 16 g
Ví dụ 4: Phản ứng nào sau đây không thể xảy ra:
A. FeSO4 + HCl → FeCl2 + H2SO4
B. Na2S + HCl → NaCl + H2S
C. FeSO4 + 2NaOH → Fe(OH)2 + Na2SO4
D. HCl + KOH → KCl + H2O
Hướng dẫn giải:
Đáp án A
Phản ứng nào không thể xảy ra là FeSO4 + HCl → FeCl2 + H2SO4
Ví dụ 5: Hoà tan hoàn toàn 2,6 gam kim loại M hóa trị II vào dung dịch HNO3 dư thu được 0,224 lít khí N2O ở đktc (sản phẩm khử duy nhất) và dung dịch muối nitrat. M là kim loại nào dưới đây?
A. Zn
B. Al
C. Ca
D. Mg
Hướng dẫn giải:
Đáp án D
2N+5 + 10e → N2+0
0,1 0,01
M → M+x + xe
1,2/M →1,2x/M
=> x/M = 0,1/1,2
x/M = 1/12
=> M là Mg
Ví dụ 6: Hòa tan hoàn toàn 2,4 gam kim loại Mg vào dung dịch HNO3 loãng chỉ thu được V lít khí N2 (đktc, sản phẩm khử duy nhất). Giá trị của V là
A. 0,672 lít
B. 6,720 lít
C. 0,448 lít
D. 4,48 lít
Hướng dẫn giải:
Đáp án C
nMg = 0,1 mol
Bảo toàn electron: 2.nMg = 10.nN2=> nN2= nMg/5 = 0,02mol
=> V = 0,02.22,4 = 0,448 lít
Ví dụ 7: Cho Mg tác dụng với dung dịch H2SO4 loãng tạo thành khí X, nhiệt phân tinh thể KNO3 tạo thành khí Y, cho tinh thể MnO2 tác dụng với dung dịch HCl đặc đun nóng tạo thành khí Z. Các khí X, Y, Z lần lượt là :
A. H2, NO2 và Cl2
B. H2, O2 và Cl2
C. Cl2, O2 và H2S
D. SO2, O2, Cl2
Hướng dẫn giải:
Đáp án B
Phương trình hóa học phản ứng
Mg + H2SO4 → MgSO4 + H2
KNO3 → KNO2 + 1/2 O2
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
Ví dụ 8: Cho m gam Mg tác dụng hoàn toàn với dung dịch H2SO4 loãng dư thu được 448 lit khí H2 (đktc). Giá trị
A. 7,2 gam
B. 4,8 gam
C. 16,8 gam
D. 3,6 gam
Hướng dẫn giải:
Đáp án B
nH2(dktc)= 4,48/22,4 = 0,2 (mol)
Phương trình hóa học:
Mg + 2HCl → MgCl2 + H2↑
(mol) 0,2 ← 0,2
Theo phương trình hóa học: nMg= nH2 = 0,2 (mol)
→ m = mMg = 0,2.24 = 4,8 (g)
Ví dụ 9: Sử dụng dung dịch Ba(OH)2 có thể phân biệt dãy dung dịch muối nào sau đây:
A. MgCl2, NH4Cl, Na2SO4, NaNO3.
B. AlCl3, ZnCl2, NH4Cl, NaCl.
C. NH4Cl, (NH4)2SO4, Na2SO4, NaNO3.
D. NH4NO3, NH4Cl, Na2SO4, NaCl.
Hướng dẫn giải:
Đáp án B
Loại A vì không phân biệt được MgCl2 và Na2SO4 vì đều tạo kết tủa trắng
Loại B vì không phân biệt được AlCl3 và ZnCl2 vì đều tạo kết tủa trắng rồi tan hết
Loại D vì không phân biệt được NH4NO3 và NH4Cl vì đều tạo khí mùi khai
Ví dụ 10: Cho từ từ 150 ml dung dịch HCl 1M vào 500 ml dung dịch X gồm K2CO3 aM và KHCO3 bM thì thu được 1,008 lít khí (đktc) và dung dịch Y. Cho dung dịch B tác dụng với dung dịch Ba(OH)2 dư thì thu được 29,55 gam kết tủa. Giá trị của a và b lần lượt là
A. 0,30 và 0,09
B. 0,21 và 0,18.
C. 0,09 và 0,30.
D. 0,15 và 0,24.
Hướng dẫn giải:
Đáp án B
Cho từ từ HCl vào dung dịch K2CO3 và KHCO3: phản ứng (1) và (2) sau đây xảy ra lần lượt:
HCl + K2CO3 → KHCO3 + KCl (1)
HCl + KHCO3 → KCl + H2O + CO2(2)
Phản ứng 1: nK2CO3 = nHCl p/u(1) = 0,5a mol
Phản ứng 2: nCO2 = nHCl p/u (2) = 0,045 mol
Tổng số mol HCl: 0,5a + 0,045 = 0,15 ⇒ a = 0,21 mol
Theo định luật bảo toàn nguyên tố C: nK2CO3 + nKHCO3 = nCO2+ nBaCO3
Vậy: 0,5a + 0,5b = 0,045 + 0,15. Thay a = 0,21 tính ra by = 0,18.
Ví dụ 11: Nhận xét nào sau đây không đúng ?
A. Tính khử của các kim loại kiềm thổ yếu hơn kim loại kiềm trong cùng chu kì
B. Các kim loại kiềm thổ có tính khử mạnh
C. Be, Mg, Ca, Sr, Ba đều phản ứng với nước ở nhiệt độ thường nên gọi là kim loại kiềm thổ
D. Tính khử của các kim loại kiềm thổ tăng dần từ Be đến Ba
Hướng dẫn giải:
Đáp án C
Nhận xét không đúng là: Be, Mg, Ca, Sr, Ba đều phản ứng với nước ở nhiệt độ thường nên gọi là kim loại kiềm thổ.
Vì Be không phản ứng với nước, còn Mg phản ứng với nước ở nhiệt độ cao.
Ví dụ 12: Cho các trường hợp sau:
(1). SO3tác dụng với dung dịch Ba(NO3)2.
(2). BaCl2 tác dụng với dung dịch H2SO4 loãng.
(3). Cho FeSO4 tác dụng với dung dịch NaOH
(4). Sục khí H2S vào dung dịch FeCl2
(5). Khí SO2 tác dụng với nước Cl2.
Số trường hợp tạo ra kết tủa là bao nhiêu?
A. 2
B. 3
C. 4
D. 5
Hướng dẫn giải:
Đáp án B
SO3+ Ba(NO3)2 + H2O → BaSO4 + 2HNO3
BaCl2 + H2SO4 → 2HCl + BaSO4↓
FeSO4 + 2NaOH → Fe(OH)2 + Na2SO4
Không phản ứng
SO2 + Cl2 + 2H2O → 2HCl + H2SO4
Ví dụ 13: Nhận định đúng về phản ứng điều chế HNO3 trong phòng thí nghiệm bằng phản ứng
NaNO3 + H2SO4 → HNO3 + NaHSO4.
A. có thể dùng axit sunfuric loãng.
B. có thể thay thế natri nitrat bằng kali nitrat.
C. axit nitric thu được ở dạng lỏng không cần làm lạnh.
D. đây là phản ứng oxi hóa khử.
Hướng dẫn giải:
Đáp án B
A sai vì không thể dùng axit sunfuric loãng.
B đúng vì có thể thay thế natri nitrat bằng kali nitrat.
C sai vì axit nitric dễ bay hơi nên thu được hơi HNO3.
D sai vì đây là phản ứng trao đổi vì không làm thay đổi số oxi hóa.
Ví dụ 14: Một dung dịch có chứa các ion sau: Ba2+, Ca2+, Mg2+, Na+, H+, Cl-. Để tách được nhiều cation ra khỏi dung dịch mà không đưa thêm ion mới vào thì ta có thể cho dung dịch tác dụng với dung dịch nào sau đây?
A. Na2SO4 vừa đủ.
B. Na2CO3 vừa đủ.
C. K2CO3 vừa đủ.
D. NaOH vừa đủ.
Hướng dẫn giải:
Đáp án B
Ta thêm vào dung dịch Na2SO4 vào sẽ loại bỏ được 1 cation
Ba2+ + SO42- → BaSO4↓
Ta thêm vào dung dịch Na2CO3 sẽ loại bỏ được 4 cation
Ba2+ + CO32- → BaCO3 ↓
Ca2+ + CO32- → CaCO3 ↓
Mg2+ + CO32- → MgCO3 ↓
2H+ + CO32- → CO2 ↑ + H2O
Loại C vì dùng K2CO3 thêm ion mới là K+
Ta thêm vào dung dịch NaOH vào sẽ loại bỏ được 2 cation:
Mg2+ + SO42- → MgSO4 ↓.
H+ + OH- → H2O
Vậy thêm Na2CO3 sẽ loại bỏ được nhiều ion nhất
Ví dụ 15: Trong các phát biểu sau về nước cứng, phát biểu nào không đúng ?
A. Nước chứa ít Ca2+, Mg2+ hay không có chứa 2 loại ion này là nước mềm.
B. Nước có chứa nhiều ion Ca2+, Mg2+ là nước cứng.
C. Nước cứng có chứa đồng thời các ion HCO3-, SO42-, Cl- là nước cứng toàn phần.
D. Nước có chứa Cl- hay SO42- hoặc cả 2 loại ion này là nước cứng tạm thời.
Hướng dẫn giải:
Đáp án D
A. Nước chứa ít Ca2+, Mg2+ hay không có chứa 2 loại ion này là nước mềm.
=> Đúng.
B. Nước có chứa nhiều ion Ca2+, Mg2+ là nước cứng.
=> Đúng
C. Nước cứng có chứa đồng thời các ion HCO3-, SO42-, Cl- là nước cứng toàn phần.
=> Đúng
D. Nước có chứa Cl- hay SO42- hoặc cả 2 loại ion này là nước cứng tạm thời.
=> Sai. Nước cứng tạm thời chứa anion HCO3- .
Ví dụ 16: Nước cứng là nước có chứa nhiều các ion
A. Mg2+, Ca2+.
B. Na+, K+.
C. Be2+, Ba2+.
D. Cl‑, HCO3-.
Hướng dẫn giải:
Đáp án A
Nước cứng là nước chứa nhiều ion Ca2+ và Mg2+.
Phân loại nước cứng:
+ Nước cứng tạm thời là nước cứng mà thành phần anion chứa ion HCO3-.
+ Nước cứng toàn phần là nước cứng mà thành phần anion chứa ion HCO3- ; Cl-
Ví dụ 17: Một loại nước cứng có chứa Ca2+ 0,004M; Mg2+ 0,004M; Cl- và . Cần lấy bao nhiêu ml dung dịch Na2CO3 0,2M để biến 1 lít nước cứng trên thành nước mềm? (coi như các chất kết tủa hoàn toàn)
A. 80 ml
B. 60 ml
C. 20 ml
D. 40 ml
Hướng dẫn giải:
Đáp án D
nCa2+ = 0,004 mol; nMg2+ = 0,004 mol
Ta có: nNa2CO3 phản ứng với Ca = nCaCO3 = nCa2+ = 0,004 mol
nNa2CO3 phản ứng với Mg = nMgCO3 = nMg2+ = 0,004 mol
=>∑nNa2CO3 = 0,004 + 0,004 = 0,008 mol => V = 0,008 / 0,2 = 0,04 lít = 40 ml
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.