Toptailieu.vn biên soạn và giới thiệu phương trình phản ứng MgCO3 → MgO + CO2 ↑ | MgCO3 ra MgO. Đây là phản ứng phân hủy đã được cân bằng chính xác và chi tiết nhất. Bài viết giới thiệu các nội dung liên quan giúp học sinh nắm bắt kiến thức cơ bản. Mời các bạn đón đọc:
Nội dung bài viết
1. Phương trình phản ứng hóa học:
MgCO3 -to→ MgO + CO2 ↑
2. Hiện tượng nhận biết phản ứng
- Có khí thoát ra, chất rắn thu được sau phản ứng có khối lượng giảm so với ban đầu.
3. Điều kiện phản ứng
- Nhiệt độ cao.
4. Tính chất hóa học
Muối MgCO3 khan không tan trong nước nhưng tan trong axit, aceton, amoniac.
Bên cạnh đó, MgCO3 còn phản ứng mãnh liệt với axit và giải phóng khí CO2.
Ngoài ra, còn có tính chất hóa học không thể không kể đến là MgCO3 tan trong amoni sunfat:
(NH4)2SO4 + MgCO3 → H2O + 2NH3 + CO2 + MgS
Thủy phân MgCO3:
MgCO3 → MgO + CO2 (ở điều kiện nhiệt độ).
MgCO3 tác dụng với axit mạnh hơn gốc (CO3)2- như HCl, H2SO4…
MgCO3 + HCl → MgCl2 + H2O + CO2.
MgCO3 + H2SO4 → MgSO4 + CO2 +H2O.
Cuối cùng, MgCO3 phân hủy tạo thành Oxit tương ứng và khí CO2:
MgCO3 → MgO + CO2.
5. Cách thực hiện phản ứng
- Nung MgCO3 ở nhiệt độ cao.
6. Bạn có biết
- Muối cacbonat trung hòa của kim loại kiềm bền với nhiệt. Muối cacbonat của kim loại khác bị nhiệt phân hủy.
7. Bài tập liên quan
Ví dụ 1: Nhiệt phân hoàn toàn hỗn hợp gồm MgCO3 và CaCO3 thu được hỗn hợp gồm
A. MgO và CaCO3.
B. Mg và Ca.
C. MgCO3 và CaO.
D. CaO và MgO.
Hướng dẫn giải:
MgCO3 ![]() MgO + CO2 ↑
MgO + CO2 ↑
CaCO3 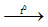 CaO + CO2 ↑
CaO + CO2 ↑
Đáp án D.
Ví dụ 2: Quặng đolomit có thành phần chính là
A. MgCO3.CaCO3.
B. FeS2.
C. MgSO4.
D. Fe3O4.
Hướng dẫn giải:
Quặng đolomit có thành phần chính là MgCO3.CaCO3.
Đáp án A.
Ví dụ 3: MgCO3 là thành phần chính của quặng nào sau?
A. pirit.
B. hemantit.
C. magiezit.
D. canxit.
Hướng dẫn giải:
thành phần chính của quặng magiezit là MgCO3.
Đáp án C.
Bài viết cùng bài học:




