Toptailieu.vn biên soạn và giới thiệu phương trình phản ứng Al2O3 + NaOH → NaAlO2 + H2O | Al2O3 ra NaAlO2. Đây là phản ứng trao đổi đã được cân bằng chính xác và chi tiết nhất. Bài viết giới thiệu các nội dung liên quan giúp học sinh nắm bắt kiến thức cơ bản. Mời các bạn đón đọc:
Nội dung bài viết
1. Phương trình phản ứng hóa học:
Al2O3 + 2NaOH → 2NaAlO2 + H2O
2. Hiện tượng nhận biết phản ứng
- Phản ứng hoà tan chất rắn nhôm oxit tạo dung dịch trong suốt.
3. Điều kiện phản ứng
- Điều kiện thường.
4. Tính chất hoá học
a. Tính chất hoá học của Al2O3
- Al2O3 là oxit lưỡng tính.
+ Tác dụng với axit:
Al2O3 + 6HCl → 2AlCl3 + 3H2O
+ Tác dụng với dung dịch bazơ mạnh
Al2O3 + 2NaOH → NaAlO2 + H2O
hay
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
Al2O3 + 2OH- → 2AlO2- + H2O
- Al2O3 tác dụng với C
Al2O3 + 9C 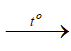 Al4C3 + 6CO
Al4C3 + 6CO
b. Tính chất hoá học của NaOH
- NaOH là một bazơ mạnh, khiến quỳ tím chuyển sang màu xanh, còn dung dịch phenolphtalein chuyển sang màu hồng.
- Phản ứng với axit tạo thành muối và nước
NaOH + HCl → NaCl + H2O
- Phản ứng với oxit axit:
2 NaOH + SO2 → Na2SO3 + H2O
NaOH + SO2 → NaHSO3
- Phản ứng với axit hữu cơ để tạo thành muối và thủy phân este, peptit
- Phản ứng với muối tạo bazo mới và muối mới
2 NaOH + CuCl2 → 2 NaCl + Cu(OH)2
- Tác dụng với kim loại lưỡng tính
2 NaOH + 2 Al + 2 H2O → 2 NaAlO2 + 3 H2
- Tác dụng với hợp chất lưỡng tính
NaOH + Al(OH)3 → NaAlO2 + 2 H2O
2 NaOH + Al2O3 → 2 NaAlO2 + H2O
5. Cách thực hiện phản ứng
- Cho Al2O3 phản ứng với dung dịch kiềm NaOH muối nhôm aluminat và nước.
6. Bạn có biết
- ZnO, Cr2O3 cũng có khả năng hòa tan trong dung dịch kiềm NaOH, riêng Cr2O3 tan trong dung dịch kiềm đặc nóng.
7. Bài tập liên quan
Ví dụ 1:Tiến hành các thí nghiệm sau:
(a) Cho dung dịch AgNO3 vào dung dịch HCl.
(b) Cho Al2O3 vào dung dịch NaOH loãng dư.
(c) Cho dung dịch FeCl2 vào dung dịch NaOH dư.
(d) Cho Ba(OH)2 vào dung dịch K2SO4.
Sau khi kết thúc phản ứng, số thí nghiệm thu được chất rắn là:
A. 2.
B. 1.
C. 4.
D. 3.
Hướng dẫn giải
Chọn D.
(a) AgNO3 + HCl → AgCl↓ + HNO3
(b) Al2O3 + 2NaOH → 2NaAlO2 + H2O
(c) FeCl2 + NaOH → Fe(OH)2↓ + 2NaCl
(d) Ba(OH)2 + K2SO4 → BaSO4↓ + 2KOH
Ví dụ 2:Cho 15,6 gam hỗn hợp X gồm Al và Al2O3 tác dụng với dung dịch NaOH dư, thu được 6,72 lít khí H2. Khối lượng Al2O3 trong X là
A. 5,4 gam.
B. 5,1 gam.
C. 10,2 gam.
D. 2,7 gam.
Hướng dẫn giải
Chọn C.
2Al + 2NaOH + 2 H2O → 2NaAlO2 + 3 H2↑ (1)
Al2O3 + 2NaOH → 2NaAlO2 + H2O (2)
nH2=![]() =0,3 mol
=0,3 mol
Theo phương trình (1) có nAl=2/3 nH2=0,2 mol
⇒ mAl=0,2.27=5,4 gam ⇒ mAl2O3=15,6-5,4=10,2 gam
Ví dụ 3:Cho các phản ứng hóa học sau:
1. H2S+ SO2 →
2. Ag + O3 →
3. Na2SO3 + H2SO4 loãng →
4. SiO2+ Mg →
5. SiO2 + HF →
6. Al2O3 + NaOH →
7. H2O2 + Ag2O →
8. Ca3P2 + H2O →
Số phản ứng oxi hóa khử là:
A. 4
B. 6
C. 5
D. 3
Hướng dẫn giải
Chọn A.
(1). H2S+ SO2 → Sinh ra S (là phản ứng oxi hóa – khử)
(2). Ag + O3 → Sinh ra O2 (là phản ứng oxi hóa – khử)
(3). Na2SO3 + H2SO4 loãng → Sinh ra SO2 (không phải oxi hóa – khử)
(4) SiO2+ Mg → Sinh ra Si (là phản ứng oxi hóa – khử)
(5). SiO2 + HF → (không phải oxi hóa – khử)
(6). Al2O3 + NaOH → (không phải oxi hóa – khử)
(7). H2O2 + Ag2O → Sinh ra O2 (là phản ứng oxi hóa – khử)
(8). Ca3P2 + H2O → (không phải oxi hóa – khử)
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.