Toptailieu.vn biên soạn và giới thiệu phương trình phản ứng KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O | KMnO4 ra MnCl2. Đây là phản ứng phản ứng oxi hóa khử đã được cân bằng chính xác và chi tiết nhất. Bài viết giới thiệu các nội dung liên quan giúp học sinh nắm bắt kiến thức cơ bản. Mời các bạn đón đọc:
Nội dung bài viết
1. Phương trình phản ứng hóa học:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
2. Hiện tượng nhận biết phản ứng
Có khí màu vàng lục thoát ra trong ống nghiệm là Cl2.
3. Điều kiện phản ứng
Dung dịch HCl đặc
4. Tính chất hoá học
a. Tính chất hoá học của KMnO4
Kali pemanganat là một chất oxy hóa rất mạnh và có thể được sử dụng như một chất oxy hóa trong một loạt các phản ứng hóa học.
Có thể thấy khả năng oxi hóa của thuốc tím khi thực hiện phản ứng oxi hóa khử với nó, trong đó dung dịch màu tím sẫm chuyển thành không màu và sau đó chuyển thành dung dịch màu nâu.
Phản ứng oxi hóa khử của KMnO4 có thể thực hiện trong môi trường axit hoặc môi trường bazơ.
Phản ứng phân hủy bởi nhiệt độ cao
2KMnO4 → K2MnO4 + MnO2 + O2
Khi pha loãng tinh thể pemanganat dưới ánh sáng mặt trời trực tiếp, oxi được giải phóng
4KMnO4 + 2H2O → 4KOH + 4MnO2 + 3O2
Phản ứng với axit
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Phản ứng với bazơ
4KMnO4 + 4KOH → 4K2MnO4 + 2H2O + O2
Tính chất oxy hóa của KMnO4
Trong môi trường axit, mangan bị khử thành Mn2+
2KMnO4 + 5Na2SO3 + 3H2SO4 ? 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
Trong môi trường trung tính, tạo thành MnO2 có cặn màu nâu.
2KMnO4 + 3K2SO3 + H2O ? 3K2SO4 + 2MnO2 + 2KOH
Trong môi trường kiềm, bị khử thành MnO42-
2KMnO4 + Na2SO3 + 2KOH ? 2K2MnO4 + Na2SO4 + H2O
Phản ứng với các hợp chất hữu cơ
Phản ứng với etanol
4KMnO4 + 3C2H5OH → 3CH3COOH + 4MnO2 + 4KOH + H2O
Phản ứng với axetilen trong môi trường kiềm:
C2H2 + 10KMnO4 + 14KOH → 10K2MnO4 + 2K2CO3 + 8H2O
Phản ứng với axetilen trong môi trường trung tính:
3C2H2 + 10KMnO4 + 2KOH → 6K2CO3 + 10MnO2 + 4H2O
Phản ứng với axetilen trong môi trường axit
C2H2 + 2KMnO4 + 3H2SO4 → 2CO2 + 2MnSO4 + K2SO4 + 4H2O
KMnO4 phản ứng với Ethylene trong môi trường kiềm:
12KMnO4 + C2H4 + 16KOH → 12K2MnO4 + 2K2CO3 + 10H2O
KMnO4 phản ứng với Ethylene trong môi trường trung tính
4KMnO4 + C2H4 → 2K2CO3 + 4MnO2 + 2H2O
Phản ứng với glycerol
14KMnO4 + 4C3H8O3 → 7K2CO3 + 7Mn2O3 + 5CO2 + 16H2O
Thuốc tím tác dụng với H2O2
2KMnO4 + 3H2O2 → 2KOH + 2MnO2 + 3O2 + 2H2O
KMnO4 tác dụng với H2S
2KMnO4 + 3H2SO4 + 5H2S → 5S + 8H2O + K2SO4 + 2Mn
b. Tính chất hoá học HCl
- Dung dịch axit HCl có đầy đủ tính chất hoá học của một axit mạnh.
Tác dụng chất chỉ thị:
Dung dịch HCl làm quì tím hoá đỏ (nhận biết axit)
HCl → H+ + Cl-
Tác dụng với kim loại
Tác dụng với KL (đứng trước H trong dãy Bêkêtôp) tạo muối (với hóa trị thấp của kim loại) và giải phóng khí hidrô (thể hiện tính oxi hóa)
Fe + 2HCl 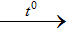 FeCl2 + H2
FeCl2 + H2
2Al + 6HCl 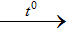 2AlCl3 + 3H2
2AlCl3 + 3H2
Cu + HCl → không có phản ứng
Tác dụng với oxit bazo và bazo:
Sản phẩm tạo muối và nước
NaOH + HCl → NaCl + H2 O
CuO + 2HCl 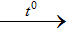 CuCl2 + H2 O
CuCl2 + H2 O
Fe2 O3 + 6HCl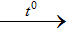 2FeCl3 + 3H2 O
2FeCl3 + 3H2 O
Tác dụng với muối (theo điều kiện phản ứng trao đổi)
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
AgNO3 + HCl → AgCl↓ + HNO3
(dùng để nhận biết gốc clorua )
Ngoài tính chất đặc trưng là axit , dung dịch axit HCl đặc còn thể hiện vai trò chất khử khi tác dụng chất oxi hoá mạnh như KMnO4, MnO2, K2 Cr2O7, MnO2, KClO3 ……
4HCl + MnO2  MnCl2 + Cl + 2H2 O
MnCl2 + Cl + 2H2 O
K2 Cr2 O7 + 14HCl → 3Cl2 + 2KCl + 2CrCl3 + 7H2 O
Hỗn hợp 3 thể tích HCl và 1 thể tích HNO3 đặc được gọi là hỗn hợp nước cường toan ( cường thuỷ) có khả năng hoà tan được Au ( vàng)
3HCl + HNO3 → 2Cl + NOCl + 2H2O
NOCl → NO + Cl
Au + 3Cl → AuCl3
5. Cách thực hiện phản ứng
Cho vào ống nghiệm khô một vài tinh thể KMnO4 nhỏ tiếp vào ống vài giọt dung dịch HCl đậm đặc. Đậy kín ống nghiệm bằng nút cao su.
6. Bạn có biết
Clo được điều chế từ axit clohidric đặc. Để oxi hóa ion Cl-, cần chất oxi hóa mạnh như MnO2, KMnO4, KClO3, …
⇒ Đây là nguyên tắc để điều chế Cl2 trong phòng thí nghiệm.
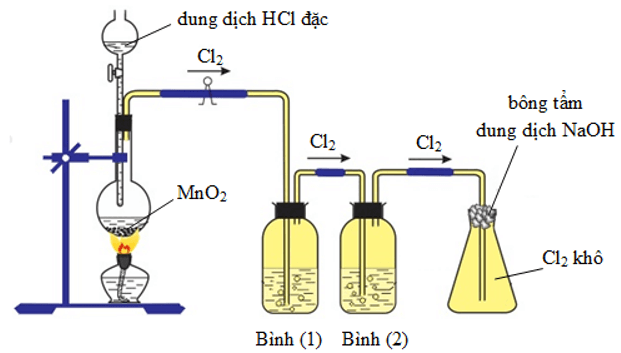
Hình 1. Điều chế và thu khí clo trong phòng thí nghiệm
7. Bài tập liên quan
Ví dụ 1: Sản phẩm khí thu được khi cho KMnO4 tác dụng với HCl đặc là
A. O2
B. Cl2
C. H2
D. MnO2
Hướng dẫn giải:
Đáp án đúng là: B
Phương trình hóa học:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
Ví dụ 2: Cho 14,6 gam HCl tác dụng hết với KMnO4 thu được V lít khí Cl2 (đktc). Giá trị V là
A. 8,96
B. 2,8
C. 5,6
D. 11,2
Hướng dẫn giải
Đáp án đúng là: B
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 ↑ + 8H2O
nHCl = = 0,4 mol
= nHCl = . 0,4 = 0,125 mol
V = 0,125. 22,4 = 2,8 lít
Ví dụ 3: Nếu cho 1 mol mỗi chất CaOCl2, KMnO4, K2Cr2O7, MnO2 lần lượt phản ứng với lượng dư dung dịch HCl đặc, chất tạo ra lượng khí Cl2 nhiều nhất là:
A. CaOCl2
B. KMnO4
C. K2Cr2O7
D. MnO2
Hướng dẫn giải
Đáp án đúng là: C
Trong phản ứng với HCl đặc, chất nào nhận electron nhiều nhất thì sẽ cho lượng Cl2 lớn nhất.
Giả sử có 1 mol mỗi chất CaOCl2, KMnO4, K2Cr2O7, MnO2 lần lượt phản ứng với lượng dư dung dịch HCl đặc thì số mol electron nhận lần lượt là 2 mol, 5 mol, 6 mol, 2 mol.
=> Kết luận: Chất tạo ra lượng khí Cl2 nhiều nhất là K2Cr2O7.
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.