Toptailieu.vn biên soạn và giới thiệu phương trình phản ứng Fe + H2SO4 → FeSO4 + H2. Đây là phản ứng oxi hóa khử đã được cân bằng chính xác và chi tiết nhất. Bài viết giới thiệu các nội dung liên quan giúp học sinh nắm bắt kiến thức cơ bản. Mời các bạn đón đọc:
Nội dung bài viết
1. Phương trình phản ứng hóa học:
Fe + H2SO4 → FeSO4 + H2
2. Hiện tượng nhận biết phản ứng
Kim loại tan dần tạo thành dung dịch màu xanh nhạt đồng thời xuất hiện bọt khí thoát ra.
3. Điều kiện phản ứng
- Không cần điều kiện
4. Tính chất hoá học
4.1. Tính chất hoá học của Sắt
- Sắt là kim loại có tính khử trung bình, tùy theo các chất oxi hóa mà sắt có thể bị oxi hóa lên mức +2 hay +3.
Fe → Fe2+ + 2e
Fe → Fe3+ + 3e
Tác dụng với phi kim
a. Tác dụng với lưu huỳnh
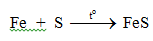
b. Tác dụng với oxi
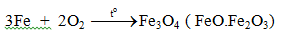
c. Tác dụng với clo
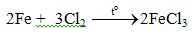
Tác dụng với axit
a.Tác dụng với dung dịch axit HCl, H2SO4 loãng
Fe + 2H+ → Fe2+ + H2
b. Với các axit HNO3, H2SO4 đặc
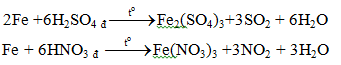
Fe + 4HNO3 l → Fe(NO3)3 + NO + 2H2O
Chú ý: Với HNO3 đặc, nguội; H2SO4 đặc, nguội: Fe bị thụ động hóa.
Tác dụng với dung dịch muối
- Fe đẩy được kim loại đứng sau ra khỏi dung dịch muối của chúng:
Fe+ CuSO4 → FeSO4 + Cu
Chú ý:
Fe + 2Ag+ → Fe2+ + 2Ag
Ag+ dư + Fe2+ → Fe3+ + Ag
4.2. Tính chất hoá học của H2SO4
Axit sunfuric loãng
- Axit sunfuric là một axit mạnh, hóa chất này có đầy đủ các tính chất hóa học chung của axit như:
- Axit sunfuric H2SO4 làm chuyển màu quỳ tím thành đỏ.
- Tác dụng với kim loại đứng trước H (trừ Pb)
Fe + H2SO4 → FeSO4 + H2
- Tác dụng với oxit bazo
FeO + H2SO4 → FeSO4 + H2O
- Tác dụng với bazo
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
- Tác dụng với muối
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
Axit sunfuric đặc
- Axit sunfuric đặc có tính axit mạnh, oxi hóa mạnh với tính chất hóa học nổi bật như:
- Tác dụng với kim loại:
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
- Tác dụng với phi kim
C + 2H2SO4 → CO2 + 2H2O + 2SO2 (nhiệt độ)
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
- Tác dụng với các chất khử khác.
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
- H2SO4 còn có tính háo nước đặc trưng
C12H22O11 + H2SO4 → 12C + H2SO4.11H2O
5. Cách thực hiện phản ứng
- Cho sắt tác dụng với dung dịch axit sunfuric loãng thu được muối sắt(II)sunfat
6. Bạn có biết
Kim loại Fe phản ứng với các axit không có tính oxi hóa như HCl; H2SO4 loãng thì chỉ tạo muối sắt (II). Còn khi cho Fe tác dụng với các axit có tính oxi hóa mạnh thì Fe sẽ bị oxi hóa lên Fe+3.
7. Bài tập liên quan
Ví dụ 1: Cho sắt tác dụng với dung dịch axit sunfuric loãng. Phương trình hóa học xảy ra là;
A. Fe + H2SO4 → FeSO4 + H2
B. 2Fe + 3H2SO4 → Fe2(SO4)3 + 3H2
C. 2Fe + 4H2SO4 → Fe2(SO4)3 + SO2 + 2H2O
D. 2Fe + 4H2SO4 → Fe2(SO4)3 + S + 4H2O
Hướng dẫn giải
Đáp án: A
Ví dụ 2: Cho 5,6 g sắt tác dụng với dung dịch axit sunfuric loãng dư thu được V lít khí H2 (đktc). Giá trị của V là:
A. 1,12 lít
B. 2,24 lít
C. 5,6 lít
D. 4,48 lít
Hướng dẫn giải
Đáp án B
Phương trình phản ứng: Fe + H2SO4 → FeSO4 + H2
nFe = 5,6/56=0,1 mol
⇒ nH2 = nFe = 0,1 mol
⇒ VH2 = 22,4.0,1 = 2,24 lít
Ví dụ 3: Trong các phản ứng sau phản ứng nào không tạo ra muối sắt(II):
A. Cho sắt tác dụng với dung dịch axit clohidric
B. Cho sắt tác dụng với dung dịch sắt(III)nitrat
C. Cho sắt tác dụng với dung dịch axit sunfuric
D. Cho sắt tác dụng với khí clo đun nóng.
Hướng dẫn giải
Đáp án D:
2Fe + 3Cl2 → 2FeCl3
Ví dụ 4: Khi cho sắt tác dụng với dụng dịch H2SO4 loãng dư hiện tượng xảy ra là gì? Chọn đáp án đúng nhất
A. Dung dịch chuyển từ không màu sang màu xanh nhạt
B. Dung dịch chuyển từ không màu xanh nhạt và có khí không màu thoát ra.
C. Kim loại tan dần tạo thành dung dịch màu xanh nhạt và có hiện tượng sủi bọt khí.
D. Kim loại tan dần tạo thành dung dịch màu xanh nhạt.
Hướng dẫn giải
Đáp án C
Ví dụ 5: Cho các kim loại sau: Cu; Au; Zn; K; Fe; Kim loại nào tác dụng được với dung dịch H2SO4 loãng?
A. Cu; Zn; Fe
B. Au; K; Fe; Zn
C. Zn; Fe
D. Zn; Fe; K
Hướng dẫn giải
Đáp án D
Zn; Fe; K là các kim loại đứng trước H trong dãy hoạt động hóa học nên phản ứng được với dung dịch H2SO4 loãng.
Ví dụ 6: Cho các chất sau: CaCO3; Ag; PbO; CuS; K2S; Fe. Số chất tác dụng với dung dịch H2SO4 loãng có tạo sản phẩm là khí là:
A. 3
B. 4
C. 5
D. 2
Hướng dẫn giải
Đáp án A.
CaCO3 + H2SO2 → CaSO4 + CO2 + H2O
K2S + H2SO4 → K2SO4 + H2S
Fe + H2SO4 → FeSO4 + H2
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.