Toptailieu.vn biên soạn và giới thiệu phương trình phản ứng Fe3O4 + KNO3 + KHSO4 → Fe2(SO4)3 + H2O + NO↑ + K2SO4 | Fe3O4 ra Fe2(SO4)3. Đây là phản ứng oxi hóa khử đã được cân bằng chính xác và chi tiết nhất. Bài viết giới thiệu các nội dung liên quan giúp học sinh nắm bắt kiến thức cơ bản. Mời các bạn đón đọc:
Nội dung bài viết
1. Phương trình phản ứng hóa học:
6Fe3O4 + 2KNO3 + 56KHSO4 → 9Fe2(SO4)3 + 28H2O + 2NO↑ + 29K2SO4
2. Hiện tượng nhận biết phản ứng
- Phản ứng có khí không màu thoát ra
3. Điều kiện phản ứng
- Nhiệt độ phòng.
4. Tính chất hoá học
4.1. Tính chất hoá học của Fe3O4
Tính oxit bazơ
- Fe3O4 tác dụng với dung dịch axit như HCl, H2SO4 loãng tạo ra hỗn hợp muối sắt (II) và sắt (III).
Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
Fe3O4 + 4H2SO4 loãng → Fe2(SO4)3 + FeSO4 + 4H2O
Tính khử
- Fe3O4 là chất khử khi tác dụng với các chất có tính oxi hóa mạnh:
3 Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO + 14H2O
Tính oxi hóa
- Fe3O4 là chất oxi hóa khi tác dụng với các chất khử mạnh ở nhiệt độ cao như: H2, CO, Al:
Fe3O4 + 4H2 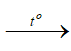 3Fe + 4H2O
3Fe + 4H2O
Fe3O4 + 4CO 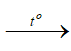 3Fe + 4CO2
3Fe + 4CO2
3 Fe3O4 + 8Al 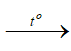 4Al2O3 + 9Fe
4Al2O3 + 9Fe
4.2. Tính chất hoá học cả KNO3
Nó có thể tham gia nhiều phản ứng hóa học như oxi hóa khử, tác dụng với axit, oxit, phản ứng phân hủy….
- Phản ứng oxi hóa khử của KNO3
S + 2KNO3 + 3C → K2S + N2 + 3CO2
Nó còn được gọi là phản ứng bột đen, lưu huỳnh và kali nitrat là chất oxy hóa.
- Phản ứng oxi hóa trong môi trường axit
6FeSO4 + 2KNO3 (đậm đặc) + 4H2SO4 → K2SO4 + 3Fe2(SO4)3 + 2NO + 4H2O
- Phản ứng phân hủy để tạo oxi
2KNO3 → 2KNO2 + O2↑
5. Cách thực hiện phản ứng
- Cho Fe2O3 tác dụng với dung dịch KNO3 và KHSO4
6. Bài tập liên quan
Ví dụ 1: Dãy các chất và dung dịch nào sau đây khi lấy dư có thể oxi hoá Fe thành Fe(III) ?
A. HCl, HNO3 đặc, nóng, H2SO4 đặc, nóng
B. Cl2, HNO3 nóng, H2SO4 đặc, nguội
C. bột lưu huỳnh, H2SO4 đặc, nóng, HCl
D. Cl2, AgNO3, HNO3 loãng
Hướng dẫn giải
Đáp án : D
Ví dụ 2: Dung dịch FeSO4 không làm mất màu dung dịch nào sau đây ?
A. Dung dịch KMnO4 trong môi trường H2SO4
B. Dung dịch K2Cr2O7 trong môi trường H2SO4
C. Dung dịch Br2
D. Dung dịch CuCl2
Hướng dẫn giải
KMnO4, K2Cr2O7, Br2 đều có tính oxi hóa mạnh nên đều tác dụng với Fe2+
Đáp án : D
Ví dụ 3: Cách nào sau đây có thể dùng để điều chế FeO ?
A. Dùng CO khử Fe2O3 ở 500°C.
B. Nhiệt phân Fe(OH)2 trong không khí.
C. Nhiệt phân Fe(NO3)2.
D. Đốt cháy FeS trong oxi.
Hướng dẫn giải
Để điều chế FeO, người ta khử Fe2O3 bằng CO ở nhiệt độ cao
Đáp án : A
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.