Toptailieu.vn biên soạn và giới thiệu phương trình phản ứng Cu + HNO3 → Cu(NO3)2 + NO + H2O. Đây là phản ứng oxi hóa khử, phương trình này sẽ xuất hiện trong nội dung các bài học: Cân bằng phản ứng oxi hóa khử Hóa học 10, tính chất Hóa học của Cu và tính chất hóa học HNO3.... cũng như các dạng bài tập. Bài viết giới thiệu các nội dung liên quan giúp học sinh nắm bắt kiến thức cơ bản. Mời các bạn đón đọc:
1. Phương trình phản ứng Cu tác dụng HNO3 loãng
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO↑ + 4H2O
2. Cân bằng phương trình phản ứng
Cu + HNO3→ Cu(NO3)2 + NO + H2O
Xác định sự thay đổi số oxi hóa
Cuo + HN+5O3→ Cu+2(NO3)2+ N+2O + H2O
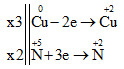
Vậy 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Nhắc lại kiến thức: Các bước cân bằng phản ứng bằng phương pháp thăng bằng electron
Bước 1. Viết sơ đồ phản ứng với các chất tham gia xác định nguyên tố có số oxi hóa thay đổi
Bước 2. Viết phương trình:
Khử (Cho electron)
Oxi hóa (nhận electron)
Bước 3. Cân bằng electron: Nhân hệ số để
Tổng số electron cho = tổng số electron nhận
Bước 4. Cân bằng nguyên tố: nói chung theo thứ tự
Kim loại (ion dương)
Gốc axit (ion âm)
Môi trường (axit, bazo)
Nước (cân bằng H2O là để cân bằng hidro)
Bước 5. Kiểm tra số nguyên tử oxi ở hai vế (phải bằng nhau)
3. Tính chất hóa học của HNO3
3.1. Axit nitric thể hiện tính axit
Axit nitric có tính chất của một axit bình thường nên nó làm quỳ tím chuyển sang màu đỏ.
Tác dụng với bazo, oxit bazo, muối cacbonat tạo thành các muối nitrat
2HNO3 + CuO → Cu(NO3)2 + H2O
2HNO3 + Mg(OH)2 → Mg(NO3)2 + 2H2O
2HNO3 + BaCO3→ Ba(NO3)2 + H2O + CO2
3.2. Tính oxi hóa của HNO3
Tác dụng với hầu hết các kim loại trừ Au và Pt tạo thành muối nitrat và nước .
Kim loại + HNO3 đặc → muối nitrat + NO + H2O ( to)
Mg + HNO3 đặc
Kim loại + HNO3 loãng → muối nitrat + NO + H2O
Kim loại + HNO3loãng lạnh → muối nitrat + H2
Mg(rắn) + 2HNO3 loãng lạnh → Mg(NO3)2 + H2 (khí)
Nhôm, sắt, crom thụ động với axit nitric đặc nguội do lớp oxit kim loại được tạo ra bảo vệ chúng không bị oxy hóa tiếp.
(Các nguyên tố á kim, ngoại trừ silic và halogen) tạo thành nito dioxit nếu là axit nitric đặc và oxit nito với axit loãng và nước, oxit của phi kim.
C + 4HNO3 đặc → 4NO2 + 2H2O + CO2
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
FeCO3 + 4HNO3 → Fe(NO3)3+ NO2 + 2H2O + CO2
3Fe(OH)2 + 10HNO3 → 3Fe(NO3)3 + NO + 8H2O
3H2S + 2HNO3 (>5%) → 3S ↓+ 2NO + 4H2O
Ag3PO4 tan trong HNO3, HgS không tác dụng với HNO3.
4. Điều kiện phản ứng Cu tác dụng với HNO3
Dung dịch HNO3 loãng dư
5. Phương trình ion thu gọn Cu tác dụng HNO3 loãng
6. Cách tiến hành phản ứng cho Cu tác dụng HNO3
Cho đồng Cu tác dụng với dung dịch axit nitric HNO3
7. Hiện tượng cho Cu tác dụng HNO3 loãng
Kim loại Cu rắn đỏ dần tạo thành dung dịch màu xanh lam và khí không màu hóa nâu trong không khí thoát ra.
8. Các phương trình khác
Al + HNO3(loãng) → Al(NO3)3 + NO↑ + H2O
Zn + HNO3(loãng) → Zn(NO3)2 + NO ↑ + H2O
Fe2O3 + HNO3(loãng) → Fe(NO3)3 + H2O
FeO + HNO3(loãng) → Fe(NO3)3 + NO + H2O
Mg + HNO3(loãng) → Mg(NO3)2 + NH4NO3 + H2O
9. Bài tập vận dụng liên quan
Câu 1. Ứng dụng nào sau đây không phải của HNO3?
A. Để điều chế phân đạm NH4NO3, Ca(NO3)2
B. Sản xuất dược phẩm
C. Sản xuất khí NO2và N2H4
D. Để sản xuất thuốc nổ, thuốc nhuộm
Đáp án C
Khi cho axit nitric tác dụng với axit clorua, ta được dung dịch cường toan có khả năng hòa tan và và bạch kim.
Axit nitric ứng dụng của axit HNO3 như chế tạo thuốc nổ (TNT, …), điều chế các hợp chất hữu cơ, sản xuất bột màu, sơn, thuốc nhuộm, …
⇒ Sản xuất khí NO2 và N2H4 không phải ứng dụng của HNO3.
Câu 2. Phát biểu nào sau đây đúng:
A. Dung dịch HNO3 làm xanh quỳ tím và làm phenolphtalein hóa đỏ.
B. Axit nitric được dùng để sản xuất phân đạm (NH4NO3, Ca(NO3)2), thuốc nổ (TNT), thuốc nhuộm, dược phẩm.
C. Trong công nghiệp, để sản xuất HNO3 người ta đun hỗn hợp (KNO3) với H2SO4 đặc
D. điều chế HNO3 trong phòng thí nghiệm người ta dùng khí amoniac (NH3)
Đáp án B
Axit nitric được dùng để sản xuất phân đạm (NH4NO3, Ca(NO3)2), thuốc nổ (TNT), thuốc nhuộm, dược phẩm.
A Sai: dung dịch HNO3 chỉ làm xanh quỳ tím hóa đỏ.
C. Trong công nghiệp để sản xuất axit nitric, người ta thường đun nóng hỗn hợp natri nitrat rắn với dung dịch H2SO4 đặc
D. Để điều chế HNO3 trong phòng thí nghiệm người ta dùng NaNO3 và H2SO4 đặc
Câu 3. Trong các thí nghiệm với dung dịch HNO3thường sinh ra khí độc NO2. Để hạn chế khí NO2 thoát ra từ ống nghiệm, người ta sử dụng biện pháp nhét bông có tẩm hóa chất và nút ống nghiệm. Hóa chất đó chính là
A. H2O
B. Dung dịch nước vôi trong
C. dung dịch giấm ăn
D. dung dịch muối ăn
Đáp án B
Phương trình phản ứng minh họa
4NO2 + 2Ca(OH)2 → Ca(NO3)2 + 2H2O + Ca(NO2)2
Khí màu nâu đỏ NO2 bị hòa tan trong dung dịch, tạo thành chất rắn Ca(NO2)2 và Ca(NO3)2
Câu 4. Có 4 dung dịch muối riêng biệt: CuCl2, ZnCl2, FeCl3, AlCl3. Nếu thêm dung dịch KOH dư, rồi thêm tiếp dung dịch NH3 dư vào 4 dung dịch trên thì số chất kết tủa thu được là
A. 1
B. 3
C. 2
D. 4
Đáp án B
Khi cho KOH dư
Cu2 + + 2OH - →Cu(OH)2↓
Zn2 + + 4OH - → 4Zn(OH)42 -
Fe3 + + 3OH - → Fe(OH)3↓
Al3 + + 4OH - →Al(OH)4 -
Thêm tiếp NH3 thì NH3 sẽ tạo phức với Cu2+, Zn2+
Zn(OH)2 + 4NH3 → [Zn(NH3)4](OH)2
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2
=> chỉ còn kết tủa Fe(OH)3
Câu 5. Cho 19,2 gam Cu tan hoàn toàn trong dung dịch HNO3 loãng dư, sau phản ứng thu được V lít NO (đktc, sản phẩm khử duy nhất). Giá trị của V là:
A. 6,72 lít
B. 2,24 lít
C. 3,36 lít
D. 4,48 lít
Đáp án D
Phương trình phản ứng hóa học
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO↑ + 4H2O
2nCu = 3nNO
=> nNO = 0,2 mol
=> V = 4,48 lit
Câu 6. Cho các phản ứng:
(1) Fe + 2HCl → FeCl2 + H2
(2) 2NaOH + (NH4)2SO4 → Na2SO4 + 2NH3+ 2H2O
(3) BaCl2 + Na2CO3 → BaCO3 + 2NaCl
(4) 2NH3 + 2H2O + FeSO4 → Fe(OH)2 + (NH4)2SO4
Các phản ứng thuộc loại phản ứng axit - bazơ là
A. (2), (4)
B. (3), (4).
C. (2), (3).
D. (1), (2).
Đáp án A
Các phản ứng thuộc loại axit – bazơ là phản ứng có chất cho proton và chất nhận proton mà ko có sự thay đổi số oxi hóa
(2) 2NaOH + (NH4)2SO4 → Na2SO4 + 2NH3 + 2H2O
(4) 2NH3 + 2H2O + FeSO4 → Fe(OH)2 + (NH4)2SO4
Câu 7. Thực hiện thí nghiệm sau: Nhỏ từ từ dung dịch NH3 cho đến dư vào ống nghiệm đựng dung dịch CuSO4. Hiện tượng quan sát đầy đủ và đúng nhất là:
A. Tạo kết tủa màu xanh lam không tan.
B. Chỉ thấy xuất hiện dung dịch màu xanh thẫm.
C. Lúc đầu có kết tủa màu xanh lam, sau đó kết tủa tan dần tạo thành dung dịch màu xanh thẫm.
D. Có kết tủa màu xanh lam tạo thành, có khí màu nâu đỏ thoát ra
Đáp án A
Các phương trình phản ứng xảy ra
CuSO4+ 2NH3+ H2O → Cu(OH)2↓xanh lam+ (NH4)2SO4
Cu(OH)2 + NH3+ H2O → [Cu(NH3)4](OH)2 (dd màu xanh thẫm)
Lúc đầu có kết tủa màu xanh lam, sau đó kết tủa tan dần tạo thành dung dịch màu xanh thẫm
Câu 8. Chỉ dùng 1 chất để phân biệt 3 kim loại sau: Al, Ba, Mg?
A. Dung dịch HCl
B. Nước
C. Dung dịch NaOH
D. Dung dịch H2SO
Đáp án B
Để phân biệt 3 kim loại Al, Ba, Mg ta dùng nước. Cho nước vào 3 mẫu kim loại, kim loại tốt trong nước và sủi bọt khí là Ba, 2 kim loại không tan trong nước là Al và Mg.
Ba + 2H2O → Ba(OH)2 + H2 ↑
Lấy dung dịch Ba(OH)2 vừa thu được đổ vào mẫu 2 kim loại còn lại, kim loại nào tan, sủi bọt khí là Al, kim loại không có hiện tượng gì là Mg
2Al + Ba(OH)2 + 2H2O → Ba(AlO2)2 + 3H2 ↑
Câu 9. Cho mẩu Cu vào dung dịch FeCl3. Hiện tượng xảy ra là:
Kim loại Fe màu trắng bám vào Cu, dung dịch chuyển sang màu xanh.
Đáp án C
Phản ứng hóa học xảy ra khi cho mẩu Cu vào dung dịch FeCl3:
Cu + 2FeCl3 → CuCl2 + FeCl2
nâu đỏ xanh
Sau phản ứng đồng tan ra, dung dịch từ màu nâu đỏ chuyển sang màu xanh.
Câu 10. Hiện tượng nào xảy ra khi cho mảnh đồng kim loại vào dung dịch HNO3 loãng
A. không có hiện tượng gì
B. dung dịch có màu xanh, H2 bay ra
C. dung dịch có màu xanh, có khí màu nâu bay ra
D. dung dịch có màu xanh lam, có khí không màu bay ra, bị hoá nâu trong không khí.
Đáp án D
Phương trình hóa học xảy ra
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
→ Hiện tượng: khi cho mảnh đồng kim loại vào dung dịch HNO3 loãng thì dung dịch có màu xanh của Cu(NO3)2 và khí màu nâu đỏ NO2.
Câu 11. Hòa tan m gam Al vào dung dịch HNO3 loãng vừa đủ, thu được 17,92 lít (đktc) hỗn hợp khí X gồm N2O và N2 biết tỉ khối hơi của X so với H2 là 18 (không còn sản phẩm khử nào khác) và dd Y chứa a gam muối nitrat. Giá trị của m là.
A. 21,6
B. 97,2
C. 64,8
D. 194,4
Đáp án C
Nhận thấy MX = (MN2 + MN2O)2 = (28 + 44)/2=36
=> nN2 = nN2O = 0,24 / 2 = 0,12 mol
Ta có: mAl(NO3)3= 213.m/27 = 7,89m < 8 => trong muối có NH4NO3
Bảo toàn e: 3nAl = 10nN2 + 8nN2O + 8nNH4NO3
=> 3.m/27 =10.0,12 + 8.0,12 + 8nNH4NO3
→ nNH4NO3 = m/72 − 0,27
Khối lượng muối tạo thành: mmuối= mAl(NO3)3 + mNH4NO3
=> 8m = 213.m/27 + 80.(m/72 – 0,27) => m = 21,6 gam
Câu 12. Nhận định đúng về phản ứng điều chế HNO3 trong phòng thí nghiệm bằng phản ứng
NaNO3 + H2SO4 → HNO3+ NaHSO4.
A. có thể dùng axit sunfuric loãng.
B. có thể thay thế natri nitrat bằng kali nitrat.
C. axit nitric thu được ở dạng lỏng không cần làm lạnh.
D. đây là phản ứng oxi hóa khử
Đáp án B
A sai vì không thể dùng axit sunfuric loãng.
B đúng vì có thể thay thế natri nitrat bằng kali nitrat.
C sai vì axit nitric dễ bay hơi nên thu được hơi HNO3.
D sai vì đây là phản ứng trao đổi vì không làm thay đổi số oxi hóa.
Câu 13. Cho các mô tả sau:
(1). Hoà tan Cu bằng dung dịch HCl đặc nóng giải phóng khí H2
(2). Ðồng dẫn nhiệt và dẫn điện tốt, chỉ thua Ag
(3). Ðồng kim loại có thể tan trong dung dịch FeCl3
(4). Có thể hoà tan Cu trong dung dịch HCl khi có mặt O2
(5). Ðồng thuộc nhóm kim loại nhẹ (d = 8,98 g/cm3)
(6). Không tồn tại Cu2O; Cu2S
Số mô tả đúng là:
A. 1.
B. 2.
C. 3 .
D. 4.
Đáp án C
1. Sai vì Cu không tác dụng với HCl.
2. Đúng
3. Đúng, Cu + 2FeCl3 → CuCl2 + 2FeCl2
4. Đúng, 2Cu + 4HCl + O2 → 2CuCl2 + 2H2O
5. Sai, đồng thuộc nhóm kim loại nặng
6. Sai, có tồn tại 2 chất trên
Câu 14. Nung 6,58 gam Cu(NO3)2 trong bình kín không chứa không khí, sau một thời gian thu được 4,96 gam chất rắn và hỗn hợp khí X. Hấp thụ hoàn toàn X vào nước để được 300 ml dung dịch Y. Dung dịch Y có pH bằng
A. 2.
B. 3.
C. 4.
D. 1.
Đáp án D
Phương trình phản ứng hóa học xảy ra
2Cu(NO3)2 → 2CuO + 4NO2 (4x) + O2 (x mol)
Áp dụng định luật bảo toàn khối lượng có:
mchất rắn ban đầu = mchất rắn sau+ mkhí
→ 6,58 = 4,96 + 46.4x + 32x → x = 0,0075 mol
Dẫn khí X vào nước
Phương trình phản ứng minh họa
O2 (0,0075) + 4NO2 (0,03) + 2H2O → 4HNO3 (0,03 mol)
CM (HNO3) = 0,03 : 0,3 = 0,1 → pH = 1.
Câu 15. Nhúng một thanh sắt nặng 100 gam vào 100 ml dung dịch hỗn hợp gồm Cu(NO3)2 0,2M và AgNO3 0,2M. Sau một thời gian lấy thanh kim loại ra, rửa sạch làm khô cân được 101,72 gam (giả thiết các kim loại tạo thành đều bám hết vào thanh sắt). Khối lượng sắt đã phản ứng là
A. 2,16 gam.
B. 0,84 gam.
C. 1,72 gam.
D. 1,40 gam.
Đáp án D
Fe (0,01) + 2Ag+ → Fe2+ + 2Ag (0,02 mol) (1)
mtăng (1) = 0,02.108 – 0,01.56 = 1,6 gam
Theo bài ra mKL tăng = 101,72 – 100 = 1,72 gam.
Tiếp tục có phản ứng:
Fe (a) + Cu2+ → Fe2+ (a mol) + Cu
mtăng (2) = 64a – 56a = 1,72 – 1,6 → a = 0,015 mol
→ mFe = (0,01 + 0,015).56 = 1,4 gam.
Câu 16. Cho Cu và dung dịch H2SO4 loãng tác dụng với chất X (một loại phân bón hóa học), thấy thoát ra khí không màu hóa nâu trong không khí. Mặt khác, khi X tác dụng với dung dịch NaOH thì có khí mùi khai thoát ra. Chất X là
A. amophot.
B. ure.
C. natri nitrat.
D. amoni nitrat.
Đáp án D
Cu và H2SO4 tác dụng với chất X có khí không màu, hóa nâu trong không khí là NO => Trong X có nhóm NO3-
Khi X tác dụng với dd NaOH → khí mùi khai → khí đó là NH3
Vậy công thức của X là NH4NO3: amoni nitrat
Phương trình hóa học: Cu + 4H2SO4 + 8NH4NO3 → 4(NH4)2SO4 + 3Cu(NO3)2 + 4H2O + 2NO↑
Phương trình phản ứng minh họa
NaOH + NH4NO3 → NaNO3 + NH3↑(mùi khai) + H2O
Câu 17. Nhúng một thanh Cu vào dung dịch AgNO3, sau một thời gian lấy ra, rửa sạch, sấy khô, đem cân thì khối lượng thanh đồng thay đổi thế nào?
A. Tăng.
B. Giảm.
C. Không thay đổi.
D. không xác định được.
Đáp án A
Giả sử có 1 mol Cu tham gia phản ứng
Phương trình phản ứng minh họa
Cu (1) + 2AgNO3 → Cu(NO3)2 + 2Ag↓ (2 mol)
→ khối lượng thanh đồng tăng = 2 × 108 - 64 = 152 gam.
húng một thanh Cu vào dung dịch AgNO3, sau một thời gian lấy ra, rửa sạch, sấy khô, đem cân thì khối lượng thanh đồng tăng
Câu 18. Hoà tan hoàn toàn 12 gam hỗn hợp Fe và Cu (tỉ lệ mol 1:1) bằng axit HNO3, thu được V lít (đktc) hỗn hợp khí X (gồm NO và NO2) và dung dịch Y (chỉ chứa hai muối và axit dư). Tỉ khối của X đối với H2 bằng 19. Giá trị của V là:
A. 2,24
B. 5,60
C. 3,36
D. 4,48
Đáp án B
Như vậy đề bài cho axit dư nên 2 muối thu được là Fe3+ và Cu2+
Gọi x là số mol Fe và Cu ta có: 56x + 64 x = 12 ⇒ x = 0,1 mol
Mặt khác:
Đặt x, y là số mol của NO và NO2 thì 30x + 46 y = 38 (x+ y)
⇒ x = y
ne nhận = 3x + y = 4x, ne cho = 0,5 ⇒ 4x = 0,5 .
Vậy x= 0,125 mol
V = 0,125.2. 22.4= 5,6 lít
Câu 19. Nung 8,4 gam Fe trong không khí, sau phản ứng thu được m gam chất rắn X gồm Fe, Fe2O3, Fe3O4, FeO. Hòa tan m gam hỗn hợp X vào dung dich HNO3 dư thu được 2,24 lít khí NO2 (đktc) là sản phẩm khử duy nhất. Giá trị của m là:
A. 11,2 gam
B. 10,2 gam
C. 7,2 gam
D. 6,9 gam
Đáp án A
Cách 1: Quy đổi hổn hợp X về hai chất FeO và Fe2O3
Phương trình phản ứng minh họa
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
0,1 0,1
nFe = 8,4/ 56 = 0,15mol
Ta có:
2Fe + O2 → 2FeO
0,1 0,2
4Fe + 3O2 → 2Fe2O3
0,05 0,025 mol
⇒mH2X = 0,1.72 + 0,025.160 = 11,2 g
Cách 2: Quy hỗn hợp X về một chất FexOy:
Phương trình phản ứng tổng quát
FexOy + (6x - 2y) HNO3 → xFe(NO3)3 + (3x - 2y) NO2 + (3x -y) H2O
0,1/3x−2y 0,1mol
Áp dụng định luật bảo toàn nguyên tố sắt:
Fe = 8,4/56 = 0,1.x/3x−2y ⇒ x/y = 6/7
Vậy công thức quy đổi là: Fe6O7 (M = 448) và
nFe6O7= 0,13.6 − 2.7 = 0,025 mol
=> mX = 0,025 . 448 = 11,2g
Câu 20. Để nhận biết ion người ta thường dùng Cu và dung dịch HNO3 loãng và đun nóng, vì:
A. Phản ứng tạo ra dung dịch có màu vàng nâu
B. Phản ứng tạo ra dung dịch có màu xanh và khí không mùi làm xanh giấy quỳ ẩm
C. Phản ứng tạo ra kết tủa màu xanh
D. Phản ứng tạo dung dịch có màu xanh và khí không màu hoá nâu trong không khí.
Đáp án D
Để nhận biết ion NO3- người ta thường dùng Cu và dung dịch H2SO4 loãng nhờ phản ứng tạo dung dịch màu xanh và khí không màu hóa nâu trong không khí.
Phương trình phản ứng ion
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.