Toptailieu.vn biên soạn và giới thiệu phương trình phản ứng Zn + HNO3 → Zn(NO3)2 + NH4NO3 + H2O. Đây là phản ứng oxi hóa khử, phương trình này sẽ xuất hiện trong nội dung các bài học: Cân bằng phản ứng oxi hóa khử Hóa học 10, tính chất Hóa học của Zn và tính chất hóa học HNO3.... cũng như các dạng bài tập. Bài viết giới thiệu các nội dung liên quan giúp học sinh nắm bắt kiến thức cơ bản. Mời các bạn đón đọc:
1. Phương trình phản ứng Zn tác dụng HNO3
4Zn + 10HNO3 → 4Zn(NO3)2 + NH4NO3 + 3H2O
2. Hướng dẫn chi tiết cân bằng phản ứng Zn tác dụng HNO3
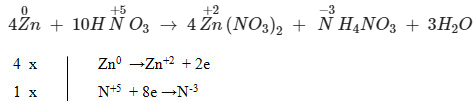
4Zn + 10HNO3 → 4Zn(NO3)2 + NH4NO3 + 3H2O
3. Điều kiện phản ứng xảy ra giữa Zn và HNO3
Nhiệt độ thường
4. Phương trình ion rút gọn Zn + HNO3
Phương trình phân tử phản ứng Zn tác dụng HNO3
4Zn + 10HNO3 → 4Zn(NO3)2 + NH4NO3 + 3H2O
Phương trình ion rút gọn:
4Zn + 10H+ + NO3- → 4Zn2+ + NH4+ + 3H2O
5. Các phương trình hóa học khác
FeO + HNO3(loãng) → Fe(NO3)3 + NO + H2O
Fe + HNO3(loãng) → Fe(NO3)3 + NO+ H2O
Cu + HNO3(loãng) → Cu(NO3)2 + NO + H2O
Al + HNO3 → Al(NO3)3 + N2 + N2O + H2O
6. Bài tập vận dụng liên quan
Câu 1. Cho hỗn hợp gồm AlCl3 và ZnCl2 tác dụng với dung dịch NH3 dư thu được kết tủa X. Lọc lấy X rồi đem nung thu được chất rắn Y. Cho khí H2 dư đi qua Y nung nóng thu được chất rắn gồm
A. Al và Zn
B. Al2O3
C. Al và ZnO
D. Al2O3 và Zn
Phương trình hóa học minh họa
AlCl3 + 3NH3 + 6H2O → Al(OH)3 + 3NH4Cl
ZnCl2 + 2NH3 + 2H2O → Zn(OH)2 + 2NH4Cl
Zn(OH)2+ NH3 dư → [Zn(NH3)6](OH)2
Câu 2. Cho phương trình hóa học: Zn + HNO3 → Zn(NO3)2 + NH4NO3 + H2O
Tổng hệ số của phương trình là
A. 22.
B. 24.
C. 25.
D. 26.
Phương trình phản ứng minh họa
4Zn + 10HNO3→ 4Zn(NO3)2+ NH4NO3 + 3H2O
Tổng hệ số của phương trình là 22.
Câu 3. Hoà tan hết hỗn hợp X gồm Zn và ZnO trong dung dịch HNO3 loãng dư thấy không có khí bay ra và trong dung dịch chứa 113,4 gam Zn(NO3)2 và 8 gam NH4NO3. Phần trăm khối lượng Zn trong X là
A. 33,33%
B. 66,67%
C. 61,61%
D. 50,00%
nZn(NO3)2 = 0,6 mol; nNH4NO3 = 0,1 mol
ZnO tác dụng với HNO3 không sinh ra sản phẩm khử vì đã đạt số oxi hóa tối đa
Bảo toàn e: 2.nZn = 8.nNH4NO3 => nZn = 4.0,1 = 0,4 mol
Bảo toàn nguyên tố Zn: nZn(NO3)2 = nZn + nZnO => nZnO = 0,6 – 0,4 = 0,2 mol
%mZn = (0,4.65)/(0,4.65 + 0,2.81).100%=61,61%
Đáp án cần chọn là: C
Câu 4. Hòa tan hoàn toàn 13,00 gam Zn trong dung dịch HNO3 loãng, dư thu được dung dịch X và 0,448 lít khí X duy nhất (đktc). Cô cạn dung dịch X thu được 39,8 gam chất rắn. Khí X là:
A. NO2
B. N2
C. N2O
D. NO
Chất rắn khan thu được chứa Zn(NO3)2 và có thể có NH4NO3.
Ta có: nZn(NO3)2 = nZn = 0,2 mol
Giả sử 1 phân tử khí trao đổi n electron.
BT electron: ne cho = n e nhận => 2nZn = 8nNH4NO3 + n.n khí => 2.0,2 = 8.0,025 + n.0,02
=> n = 10 => X là N2
Câu 5. Dãy các hợp chất vừa tác dụng được với dung dịch HCl vừa tác dụng với dung dịch NaOH là:
A. AlCl3, Al2O3, Al(OH)3
B. Al2O3, Al(OH)3, NaHCO3
C. Zn(OH)2, Al2O3, Na2CO3
D. ZnO, Zn(OH)2, NH4Cl
Al2O3, Al(OH)3, NaHCO3 là các chất lưỡng tính nên vừa tác dụng được với dung dịch HCl vừa tác dụng với dung dịch NaOH.
Al2O3 + 6HCl → 2AlCl3 + 3 H2O
Al2O3+2NaOH→2NaAlO2 +H2O
Al(OH)3 + 3HCl → AlCl3 + 3H2O
Al(OH)3 + NaOH → NaAlO2 + 2H2O
NaHCO3+ HCl → NaCl + CO2+ H2O
NaHCO3+ NaOH → Na2CO3+ H2O
Câu 6. Cho m gam bột Zn vào 500 ml dung dịch Fe2(SO4)3 0,24M. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng dung dịch tăng thêm 9,6 gam so với khối lượng dung dịch ban đầu. Giá trị của m là
A. 29,25.
B. 48,75.
C. 32,50.
D. 20,80.
nFe2(SO4)3 = 0,24.0,5 = 0,12mol
nFe3+= 0,24 mol
Zn + 2Fe3+ → Zn2+ + 2Fe2+
0,12….0,24…………….0,24
Zn + Fe2+ → Zn2+ + Fe
x……………………x
→ mdd tăng = mZn- mFe= 65.(0,12 + x) – 56x = 9,6 → x = 0,2
=> nZn ban đầu = 0,12 + 0,2 = 0,23 mol
=> mZn = 0,32.65 = 20,8 gam
Câu 7. Tiến hành các thí nghiệm sau:
(1) Cho Zn vào dung dịch Fe2(SO4)3 dư.
(2) Cho bột Mg vào lượng dư dung dịch HCl.
(3) Dẫn khí H2 dư qua ống sứ chứa bột Fe2O3 nung nóng.
(4) Cho Ca vào lượng dư dung dịch CuSO4.
(5) Cho dung dịch Fe(NO3)2 vào dung dịch AgNO3.
Sau khi kết thúc các phản ứng, số thí nghiệm thu được kim loại là
A. 4
B. 2
C. 3
D. 1
(1) Zn + Fe2(SO4)3dư → ZnSO4 + 2FeSO4 => không thu được kim loại
(2) Mg + 2HCl dư → MgCl2 + H2 => không thu được kim loại
(3) H2dư + Fe2O3 → Fe + H2O => thu được kim loại Cu
(4) Ca + 2H2O → Ca(OH)2+ H2
CuSO4+ Ca(OH)2 → Cu(OH)2 + CaSO4
=> không thu được kim loại
(5) Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag => thu được kim loại Ag
Vậy có 2 thí nghiệm thu được kim loại sau phản ứng là (3) và (5)
Câu 8. Để khử hoàn toàn hỗn hợp FeO và ZnO thành kim loại cần 4,48 lít H2 (đktc). Nếu đem hỗn hợp kim loại thu được hòa tan hoàn toàn bằng dung dịch HCl thì thể tích H2 (đktc) thu được là:
A. 4,48 lít
B. 2,24 lít
C. 3,36 lít
D. 1,12 lít
nhh oxit = nH2 = nhh kim loại = 0,2 mol
Khi hoà tan hỗn hợp kim loại cùng hóa trị II vào axit thì:
nH2 = nhh kim loại = 0,2 mol
VH2 = 22,4.0,2 = 4,48 lít
Câu 9. Cho m gam hỗn hợp hai kim loại Fe, Zn tác dụng hết với 200 ml dung dịch HCl 1,6M thoát ra 3,36 lít (đktc) khí H2. Dung dịch thu được có giá trị pH là (bỏ qua các quá trình thuỷ phân của muối)
A. 2.
B. 7.
C. 4.
D. 1.
nkhí = 0,15 mol → nHCl pư = 2.nkhí = 0,3 mol
nHCl dư = 0,2.1,6 – 0,3 = 0,02 mol
→ CM (HCl dư) = 0,02 : 0,2 = 0,1M → pH = 1.
Câu 10. Cho 500ml dung dịch NaOH 1M tác dụng với 200 ml dung dịch ZnSO4 1M, sau phản ứng thu được a gam kết tủa . Giá trị của a là
A. 9,425.
B. 8,425.
C. 7,425.
D. 14,855
nOH- = nNaOH= 0,5.1 = 0,5 mol
nZn2+ = nZnCl2 = 0,2.1 = 0,2 mol
Phương trình hóa học:
2NaOH + ZnSO4 → Zn(OH)2↓ + Na2SO4 (1)
(0,5) (0,2) (0,2 mol)
NaOH dư 0,1 mol, tiếp tục có phản ứng:
2NaOH + Zn(OH)2 → Na2[Zn(OH)4] (2)
(0,1) (0,1 mol)
Sau phản ứng (1) và (2) n↓ = 0,2 – 0,05 = 0,15 mol
→ m↓ = a = 0,15.99 = 14,85 g
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.