Toptailieu.vn biên soạn và giới thiệu phương trình phản ứng Al + HNO3 → Al(NO3)3 + NH4NO3 + H2O. Đây là phản ứng oxi hóa khử, phương trình này sẽ xuất hiện trong nội dung các bài học: Cân bằng phản ứng oxi hóa khử Hóa học, tính chất Hóa học của Al và tính chất hóa học HNO3 .... cũng như các dạng bài tập. Bài viết giới thiệu các nội dung liên quan giúp học sinh nắm bắt kiến thức cơ bản. Mời các bạn đón đọc:
Nội dung bài viết
1. Phương trình phản ứng Al tác dụng với HNO3 loãng ra NH4NO3
8Al + 30HNO3 → 8Al(NO3)3 + 3NH4NO3+ 9H2O
2. Cân bằng phản ứng
Sử dụng phương pháp thăng bằng electron cân bằng phản ứng oxi hóa khử Al + HNO3 → Al(NO3)3 + NH4NO3 + H2O
Al0 + HN+5O3→ Al+3(NO3)3 + N-3H4NO3 + H2O
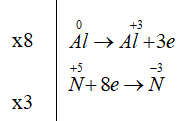
Điền hệ số 8 vào Al, Al+3; điền hệ số 3 vào N-3
Vậy phương trình phản ứng: 8Al + 30HNO3 → 8Al(NO3)3 + 3NH4NO3 + 9H2O
3. Điều kiện Al tác dụng với HNO3
Nhiệt độ phòng
4. Tính chất hóa học của nhôm
4Al + 3O2→ 2Al2O3
ở điều kiện thường, nhôm phản ứng với oxi tạo thành lớp Al2O3 mỏng bền vững, lớp oxit này bảo vệ đồ vật bằng nhôm, không cho nhôm tác dụng oxi trong không khí, nước.
2Al + 3Cl2 → 2AlCl3
2Al + 6HCl → 2AlCl3 + 3H2
Chú ý: Nhôm không tác dụng với H2SO4, HNO3đặc, nguội
Al + 4HNO3→ Al(NO3)3 + NO + 2H2O
Al + 6HNO3 → Al(NO3)3 + 3NO2 + 3H2O
2Al + 6H2SO4 → Al2(SO4)3 + 3SO2 + 6H2O
AI + 3AgNO3 → Al(NO3)3 + 3Ag
2Al + 3FeSO4 → Al2(SO4)3 + 3Fe
Do lớp oxit nhôm bị hòa tan trong kiềm nên nhôm phản ứng với dung dịch kiềm.
2Al + 2H2O + 2NaOH → 2NaAlO2+ 3H2↑
Phản ứng nhiệt nhôm là phản ứng hóa học toả nhiệt trong đó nhôm là chất khử ở nhiệt độ cao.
Ví dụ nổi bật nhất là phản ứng nhiệt nhôm giữa oxit sắt III và nhôm:
Fe2O3+ 2Al → 2Fe + Al2O3
Một số phản ứng khác như:
3CuO+ 2Al → Al2O3 + 3Cu
8Al + 3Fe3O4 → 4Al2O3 + 9Fe
5. Các phương trình hóa học khác
Al + HNO3 → Al(NO3)3 + N2 + N2O + H2O
Al + HNO3 → Al(NO3)3 + N2 + H2O
Al + HNO3 → Al(NO3)3 + N2O + H2O
Al + HNO3 → Al(NO3)3 + NO2 + 3H2O
Al + HNO3 → Al(NO3)3 + NO + H2O
6. Bài tập vận dụng liên quan
Câu 1. Cho phản ứng hoá học sau:
Al + HNO3→ Al(NO3)3+ NH4NO3+ H2O
Tổng hệ số cân bằng (là số nguyên, tối giản) của phản ứng trên là:
A. 58
B. 60
C. 48
D. 62
Sử dụng phương pháp thăng bằng electron cân bằng phản ứng oxi hóa khử Al + HNO3 → Al(NO3)3 + NH4NO3 + H2O
Al0 + HN+5O3→ Al+3(NO3)3 + N-3H4NO3 + H2O
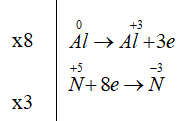
Điền hệ số 8 vào Al, Al+3; điền hệ số 3 vào N-3
Vậy phương trình phản ứng: 8Al + 30HNO3 → 8Al(NO3)3 + 3NH4NO3 + 9H2O
Câu 2. Thuốc thử dùng để nhận biết ba axit đặc nguội HNO3, H2SO4, HCl đựng trong ba lọ mất nhãn:
A. Cu
B. Al
C. Cr
D. CuO
B, C sai vì Fe và Al bị thụ động hóa trong H2SO4 đặc nguội và HNO3 đặc nguội.
D sai vì CuO tác dụng với 3 axit đều tạo dung dịch màu xanh và không có khí thoát ra
A đúng vì
Cu + HCl → không phản ứng
Cu + 2H2SO4 → CuSO4 + SO2↑ + 2H2O
Khí mùi hắc
Cu + 4HNO3 → Cu(NO3)2 + 2NO2↑ + 2H2O
Khí màu nâu
Câu 3. Hòa tan hoàn toàn 6,5 gam Zn trong dung dịch HNO3 loãng, dư thu được dung dịch A và 0,224 lít khí N2 (đktc). Khối lượng muối trong dung dịch A là
A. 18,90 gam
B. 19,9 gam
C. 39,80 gam
D. 28,35 gam
nZn= 6,5/65 = 0,1 (mol);
nN2 = 0,224/22,4 = 0,01 (mol)
Ta thấy:
necho= 2nZn= 0,2 (mol) > nenhan= 10nN2= 0,1 (mol)
→ Sản phẩm khử có chứa NH4NO3
Quá trình cho - nhận e:
0Zn → +2Zn + 2e 2N+5 + 10e → 2N0 (N2)
2N+5 + 8e→ N-3 (NH4NO3)
Áp dụng bảo toàn e:
2nZn= 10nN2 + 8nNH4NO3
⇔2.0,1 =10.0,01 + 8nNH4NO3
⇔nNH4NO3 = 0,0125 (mol)
Muối trong dung dịch A gồm:
0,1 mol Zn(NO3)2 và 0,0125 mol NH4NO3
→ mmuối = 0,1.189 + 0,0125.80 = 19,9 gam
Câu 4. Trong phòng thí nghiệm, người ta thường điều chế HNO3 từ
A. NaNO2và H2SO4 đặc.
B. NaNO3 và H2SO4 đặc.
C. NH3 và O2.
D. N2O5 và H2O.
Để điều chế HNO3 trong phòng thí nghiệm người ta dùng NaNO3 và H2SO4đặc
Phương trình phản ứng liên quan
H2SO4 + NaNO3 → NaHSO4+ HNO3
Câu 5. Khẳng định nào sau đây đúng khi nói về tính chất của nhôm?
A. Nhôm là kim loại nặng
B. Nhôm là kim loại tác dụng mạnh với nước.
C. Vật dụng bằng nhôm để lâu ngày cũng không tác dụng với nước do có màng oxit bao bọc
D. Nhôm là kim loại kiềm thổ
A sai nhôm là kim loại nhẹ
B sai nhôm tác dụng yếu với nước do tạo màng oxit
C đúng những vật bằng nhôm hàng ngày tiếp xúc với nước dù ở nhiệt độ nào cũng không xảy ra phản ứng vì trên bề mặt vật được phủ một lớp nhôm oxit mỏng, bền, ngăn cách vật với nước.
D sai vì nhôm là kim loại nhóm IIIA.
Câu 6. Cho các thí nghiệm sau:
(a) Sục khí CO2 đến dư vào dung dịch natri aluminat.
(b) Nhúng thanh sắt vào dung dịch H2SO4 loãng, nguội.
(c) Sục khí SO2 đến dư vào nước brom.
(d) Cho một mẩu Li vào bình kín chứa khí N2ở nhiệt độ thường.
(e) Dẫn khí H2S đến dư qua dung dịch CuSO4.
(g) Rắc bột lưu huỳnh lên thuỷ ngân bị rơi vãi.
Số thí nghiệm có xảy ra phản ứng oxi hoá – khử là
A. 3.
B. 5.
C. 4.
D. 6.
Phương trình hóa học minh họa liên quan
NaAlO2+ CO2 + 2H2O → Al(OH)3↓ + NaHCO3
Fe + H2SO4 → FeSO4 + H2
SO2 + Br2 + 2H2O → 2HBr + H2SO4
6Li + N2 → 2Li3N
H2S + CuSO4 → CuS↓ + H2SO4
S + Hg → HgS
Câu 7. Có các thí nghiệm sau:
(I) Nhúng thanh sắt vào dung dịch H2SO4 loãng, nguội.
(II) Sục khí SO2vào nước brom.
(III) Sục khí CO2 vào nước Gia-ven.
(IV) Nhúng lá nhôm vào dung dịch H2SO4 đặc, nguội.
Số thí nghiệm xảy ra phản ứng hóa học là:
A. 4
B. 3
C. 1
D. 2
Thí nghiệm xảy ra phản ứng hóa học là (I); (II); (III)
Fe + H2SO4 → FeSO4 + H2
SO2 + Br2 + 2H2O → 2HBr + H2SO4
CO2 + H2O + NaClO → NaHCO3 + HClO
Câu 8. Cho khí H2S lội qua dung dịch CuSO4 thấy có kết tủa màu xám đen xuất hiện, chứng tỏ:
A. Có phản ứng oxi hoá - khử xảy ra.
B. Có kết tủa CuS tạo thành, không tan trong axit mạnh.
C. Axit sunfuhiđric mạnh hơn axit sunfuric.
D. Axit sunfuric mạnh hơn axit sunfuhiđric.
Phương trình hóa học minh họa
H2S + CuSO4 → CuS↓ (kết tủa đen) + H2SO4
=> Có kết tủa CuS tạo thành, không tan trong axit mạnh.
Câu 9. Cho sơ đồ sau: muối X + HCl → muối Y + H2S. Dãy các chất nào sau đây có thể là X?
A. BaS, FeS, PbS, K2S.
B. KHS, Ag2S, FeS, Na2S.
C. Na2S, CuS, FeS, MgS.
D. NaHS, ZnS, FeS, MgS.
Loại 1: Tan trong nước và tan trong axit mạnh sinh ra khí H2S gồm Na2S, K2S, CaS và BaS, (NH4)2S.
Na2S + 2HCl → 2NaCl + H2S↑
+ Loại 2: Không tan trong nước nhưng tan trong axit mạnh gồm FeS, ZnS...
ZnS + 2H2SO4 → ZnSO4 + H2S↑
+ Loại 3: Không tan trong nước và không tan trong axit gồm CuS, PbS, HgS, Ag2S...
Câu 10. Cho các dung dịch loãng : (1) FeCl3, (2) FeCl2, (3) H2SO4, (4) HNO3, (5) hỗn hợp gồm HCl và NaNO3. Những dung dịch phản ứng được với Cu là
A. (1), (3), (5).
B. (1), (2), (3).
C. (1), (3), (4).
D. (1), (4), (5).
Những dung dịch phản ứng được với Cu là (1) FeCl3; (4) HNO3; (5) hỗn hợp HCl và NaNO3
Phương trình hóa học minh họa
Cu + FeCl3 → CuCl2 + FeCl2
3Cu + 8HNO3 → 3Cu(NO3)2+ 2NO↑ + 4H2O
3 Cu + 2 NaNO3+ 8 HCl → 3 CuCl2+ 2 NO + 2 NaCl + 4 H2O
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.