Toptailieu.vn biên soạn và giới thiệu phương trình phản ứng Mg + HNO3 → Mg(NO3)2 + NH4NO3 + H2O. Đây là phản ứng oxi hóa khử, phương trình này sẽ xuất hiện trong nội dung các bài học: Cân bằng phản ứng oxi hóa khử Hóa học 10, tính chất Hóa học của Mg và tính chất hóa học HNO3.... cũng như các dạng bài tập. Bài viết giới thiệu các nội dung liên quan giúp học sinh nắm bắt kiến thức cơ bản. Mời các bạn đón đọc:
Nội dung bài viết
1. Phương trình phản ứng Mg + HNO3 ra NH4NO3
4Mg + 10HNO3 → 4Mg(NO3)2 + NH4NO3 + 3H2O
2. Cân bằng phản ứng Mg + HNO3 → Mg(NO3)2 + NH4NO3 + H2O
Mg0 + HN+5O3 → Mg+2(NO3)2 + N-3H4NO3 + H2O
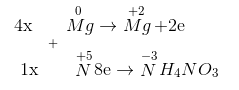
Tỉ lệ 2 muối nitrat của amoni và magiê là 1:4.
4Mg + 10HNO3 → 4Mg(NO3)2 + NH4NO3 + 3H2O
3. Điều kiện để phản ứng Mg tác dụng HNO3 loãng ra NH4NO3
Nhiệt độ thường
4. Bản chất của các chất tham gia phản ứng
- Trong phản ứng trên Mg là chất khử.
- Mg là chất khử mạnh tác dụng được với các axit.
- Trong phản ứng trên HNO3 là chất oxi hoá.
- Đây là một monoaxit mạnh, có tính oxi hóa mạnh có thể nitrat hóa nhiều hợp chất vô cơ.
5. Các phương trình hóa học khác
FeO + HNO3(loãng) → Fe(NO3)3 + NO + H2O
Mg + HNO3(đặc) → Mg(NO3)2 + NO2 + H2O
Al + HNO3(loãng) → Al(NO3)3 + N2O + H2O
6. Bài tập vận dụng liên quan
Câu 1. Cho phương trình: Mg + HNO3 → Mg(NO3)2+ NH4NO3 + H2O
Tổng hệ số cân bằng tối giản của phản ứng trên là
A. 23
B. 24
C. 18
D. 22
Lời giải:
Câu 2. Cho Mg tan hoàn toàn trong dung dịch HNO3 loãng không thấy có khí thoát ra . Trong phương trình phản ứng tổng hệ số của các chất (nguyên, tối giản) là bao nhiêu?
A. 20
B. 24
C. 25
D. 22
Lời giải:
Câu 3. Cho 4,8 gam Mg tác dụng với dung dịch HNO3 dư. Sau khi phản ứng xảy ra hoàn toàn thu được 1,792 lít NO (đktc) và dung dịch X. Khối lượng muối khan thu được khi cô cạn dung dịch X là
A. 13,92 gam
B. 15,60 gam
C. 16,80 gam
D. 31,20 gam
Lời giải:
Ta có:
nMg = 0,2 mol
nNO = 0,08 mol
Các quá trình trao đổi electron
Mg0 → Mg+2 + 2e
0,2 → 0,4
N+5 + 3e→ N+2
0,24 ← 0,08
Vậy còn 1 sản phẩm khử nữa là NH4NO3
N+5 + 8e → N-3
8x → x
Áp dụng bảo toàn electron ta có:
0,4 = 0,24 + 8x → a = 0,02 mol
=> mmuối = mNH4NO3 + mMg(NO3)2 = 31,2 gam
Câu 4. Hòa tan hỗn hợp gồm 2,7 gam Al và 13 gam Zn bằng 500 ml dung dịch HNO3 vừa đủ, thu được dung dịch X và không thấy khí thoát ra. Cô cạn dung dịch X thu a gam muối. Giá trị của a:
A. 66,1 gam
B. 76,8
C. 45,89
D. 22,65
Lời giải:
nAl = 2,727 = 0,1 mol
nZn = 1365 = 0,2 mol
Không thấy khí thoát ra => Sản phẩm khử là NH4NO3
⇒ nNH4NO3 = 0,1.3+0,2.28 =0,78 mol
Dung dịch muối X gồm: Al(NO3)3 (0,1 mol); Zn(NO3)2 (0,2 mol), NH4NO3 (0,78 mol)
m = mAl(NO3)3 + mZn(NO3)2 + mNH4NO3 = 0,1.213 + 0,2.189 + (0,78).80 = 66,1 gam
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.