Toptailieu.vn biên soạn và giới thiệu phương trình phản ứng 2Li + S → 2Li2S | Li ra Li2S | S ra Li2S. Phản ứng 2Li + S → 2Li2S | Li ra Li2S | S ra Li2S thuộc loại phản ứng oxi hóa khử, phản ứng hóa hợp đã được cân bằng chính xác và chi tiết nhất. Bài viết giới thiệu các nội dung liên quan giúp học sinh nắm bắt kiến thức cơ bản.. Mời các bạn đón đọc:
1. Phương trình phản ứng hóa học:
2Li + S → Li2S
2. Hiện tượng nhận biết phản ứng
Li phản ứng với lưu huỳnh đun nóng tỏa nhiều nhiệt tạo chất rắn màu trắng.
3. Điều kiện phản ứng
- Nhiệt độ
4. Tính chất hóa học
- Liti là kim loại kiềm có tính khử rất mạnh.
Li → Li+ + 1e
a. Tác dụng với phi kim
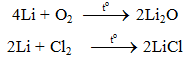
b. Tác dụng với axit
- Liti dễ dàng khử ion H+ (hay H3O+) trong dung dịch axit loãng (HCl, H2SO4 loãng...) thành hidro tự do.
2Li + 2HCl → 2LiCl + H2.
2Li + H2SO4 → Li2SO4 + H2.
c. Tác dụng với nước
- Li tác dụng chậm với nước tạo thành dung dịch kiềm và giải phóng khí hidro.
2Li + 2H2O → 2LiOH + H2.
d. Tác dụng với hidro
- Liti tác dụng với hidro ở áp suất khá lớn và nhiệt độ khoảng 350 – 400oC tạo thành Liti hidrua.
2Li (lỏng) + H2 (khí) → 2LiH (rắn)
5. Cách thực hiện phản ứng
- Cho liti tác dụng với lưu huỳnh thu được litisunfua.
6. Bạn có biết
Li tham gia phản ứng mãnh liệt với các phi kim.
7. Bài tập liên quan
Ví dụ 1: Nguyên tử kim loại kiềm có n lớp electron. Cấu hình electron lớp ngoài cùng của nguyên tử kim loại kiềm là
A. ns1
B. ns2
C. ns2np1
D. (n-1)dxnsy
Đáp án: A
Ví dụ 2: Muối litisunfua thu được khi cho liti tác dụng với S có tính chất gì?
A. Tan trong nước tạo thành dung dịch có pH = 7
B. Tan trong nước tạo thành dung dịch có pH > 7
C. Tan trong nước tạo thành dung dịch có pH < 7
D. Không tan trong nước
Đáp án: B
Hướng dẫn giải:
Li2S → 2Li+ + S2- ;
S2- + H2O → HS- + OH-
Ví dụ 3: Cho 0,7 g Li tác dụng với 1,6 g phi kim X thu được muối của K2X. X là
A. Cl2
B. Br2
C. S
D. O2
Hướng dẫn giải:
Phương trình phản ứng: 2Li + S → Li2S
nX = nLi/2 = 0,05 mol ⇒ MX = 1,6/0,05 = 32 g ⇒ X là S
Xem thêm Một số phương trình phản ứng hóa học khác của Li, chi tiết khác:
Bài viết cùng bài học:




