Toptailieu.vn biên soạn và giới thiệu phương trình phản ứng 6Li + N2 → 2Li3N | Li ra Li3N | N2 ra Li3N. Phản ứng 6Li + N2 → 2Li3N | Li ra Li3N | N2 ra Li3N thuộc loại phản ứng oxi hóa khử, phản ứng hóa hợp đã được cân bằng chính xác và chi tiết nhất. Bài viết giới thiệu các nội dung liên quan giúp học sinh nắm bắt kiến thức cơ bản.. Mời các bạn đón đọc:
1. Phương trình phản ứng hóa học:
6Li + N2 → 2Li3N
2. Hiện tượng nhận biết phản ứng
Li cháy sáng mạnh trong khí nitơ.
3. Điều kiện phản ứng
- Nhiệt độ 200-250oC; áp suất
4. Tính chất hóa học
4.1. Tính chất hóa học của Liti (L)
- Liti là kim loại kiềm có tính khử rất mạnh.
Li → Li+ + 1e
a. Tác dụng với phi kim
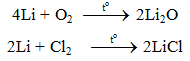
b. Tác dụng với axit
- Liti dễ dàng khử ion H+ (hay H3O+) trong dung dịch axit loãng (HCl, H2SO4 loãng...) thành hidro tự do.
2Li + 2HCl → 2LiCl + H2.
2Li + H2SO4 → Li2SO4 + H2.
c. Tác dụng với nước
- Li tác dụng chậm với nước tạo thành dung dịch kiềm và giải phóng khí hidro.
2Li + 2H2O → 2LiOH + H2.
d. Tác dụng với hidro
- Liti tác dụng với hidro ở áp suất khá lớn và nhiệt độ khoảng 350 – 400oC tạo thành Liti hidrua.
2Li (lỏng) + H2 (khí) → 2LiH (rắn)
4.2. Tính chất hóa học của Nito (N2)
- Nitơ có các số oxi hoá: -3, 0, +1, +2, +3, +4, +5.
- N2 có số oxi hoá 0 nên vừa thể hiện tính oxi hoá và tính khử.
- Nitơ có EN N = 946 kJ/mol, ở nhiệt độ thường nitơ khá trơ về mặt hóa học nhưng ở nhiệt độ cao hoạt động hơn.
- Nitơ thể hiện tính oxi hóa và tính khử, tính oxi hóa đặc trưng hơn.
1. Tính oxi hoá: Phân tử nitơ có liên kết ba rất bền, nên nitơ khá trơ về mặt hóa học ở nhiệt độ thường.
a. Tác dụng với hidro
Ở nhiệt độ cao, áp suất cao và có xúc tác. Nitơ phản ứng với hidro tạo amoniac.
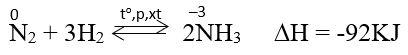
b. Tác dụng với kim loại
- Ở nhiệt độ thường nitơ chỉ tác dụng với liti tạo liti nitrua: 6Li + N2 → 2Li3N.
- Ở nhiệt độ cao, nitơ tác dụng với nhiều kim loại: 3Mg + N2 → Mg3N2 (magie nitrua).
Lưu ý: Các nitrua dễ bị thủy phân tạo NH3.
Nitơ thể hiện tính oxi hoá khi tác dụng với nguyên tố có độ âm điện nhỏ hơn.
2. Tính khử
- Ở nhiệt độ cao (3000 ºC) Nitơ phản ứng với oxi tạo nitơ monoxit.
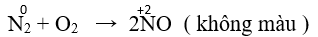
- Ở điều kiện thường, nitơ monoxit tác dụng với oxi không khí tạo nitơ đioxit màu nâu đỏ.
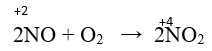
Nitơ thể hiện tính khử khi tác dụng với nguyên tố có độ âm điện lớn hơn.
- Các oxit khác của nitơ: N2O, N2O3, N2O5 không điều chế được trực tiếp từ nitơ và oxi.
Ghi nhớ: Nitơ thể hiện tính khử khi tác dụng với các nguyên tố có độ âm điện lớn hơn. Thể hiện tính oxi hóa khi tác dụng với các nguyên tố có độ âm điện lớn hơn.
5. Cách thực hiện phản ứng
- Cho Liti tác dụng với khí nitơ
6. Bạn có biết
Li tham gia phản ứng với cả các chất khí trơ như Ar nhưng điều kiện khó khăn hơn.
7. Bài tập liên quan
Ví dụ 1:. Khi cho li tác dụng với khí N2. Điều kiện để phản ứng xảy ra là
A. Nhiệt độ
B. Áp suất
C. Xúc tác
D. A và B
Đáp án: D
Ví dụ 2: Cho m g Li tác dụng vừa đủ với 3,36 lít khí N2 (đktc). Khối lượng liti tham gia phản ứng là
A. 1,05 g
B. 0,7 g
C. 6,3 g
D. 0,63 g
Đáp án: C
Hướng dẫn giải:
6Li + N2 → 2Li3N
nLi = 6.nN2 = 0,9 mol ⇒ mLi = 0,9.7 = 6,3 g
Ví dụ 3: Cho li tác dụng với V lít khi Nito thu được 3,5 g chất rắn màu trắng. Giá trị của V là
A. 2,24 lít
B. 1,12 lít
C. 3,36 lít
D. 4,48 lít
Đáp án: B
Hướng dẫn giải:
6Li + N2 → 2Li3N
nN2 = nLi3N/2 = 0,05 mol ⇒ VN2 = 0,05.22,4 = 1,12 lít
Xem thêm Một số phương trình phản ứng hóa học khác của Li, chi tiết khác:
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.