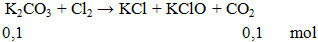Toptailieu.vn biên soạn và giới thiệu phương trình phản ứng K2CO3 + Cl2 → KCl + KClO + CO2 | K2CO3 ra KCl. Phản ứng K2CO3 + Cl2 → KCl + KClO + CO2 | K2CO3 ra KCl thuộc loại phản ứng oxi hóa khử đã được cân bằng chính xác và chi tiết nhất. Bài viết giới thiệu các nội dung liên quan giúp học sinh nắm bắt kiến thức cơ bản. Mời các bạn đón đọc:
Nội dung bài viết
1. Phương trình phản ứng hóa học:
K2CO3 + Cl2 → KCl + KClO + CO2
2. Hiện tượng nhận biết phản ứng
- Có khí không màu thoát ra.
3. Điều kiện phản ứng
- điều kiện thường,
4. Tính chất hóa học
- Tác dụng vói axit mạnh hơn tạo ra muối mới
K2CO3 + 2CH3COOH → 2CH3COOK + CO2 + H2O
K2CO3 + H2SO4 → K2SO4 + CO2 + H2O
- Phản ứng với dung dịch kiềm tạo nên muối
K2CO3 + NaOH → Na2CO3 + KOH
- Tác dụng với dung dich muối để tạo ra muối mới bền vững hơn
K2CO3 + NaCl → KCl + Na2CO3
- Dễ bị phân hủy ở nhiệt độ cao để giải phóng khí cacbonic
K2CO3 → K2O + CO2
5. Cách thực hiện phản ứng
- Sục khí clo vào ống nghiệm chứa K2CO3.
6. Bạn có biết
- Khi cho Cl2 vào K2CO3, clo sẽ tác dụng với nước, tạo thành axit theo pthh:
Cl2 + H2O ⇌ HCl + HClO
Axit sinh ra phản ứng với K2CO3 giải phóng CO2.
7. Bài tập liên quan
Ví dụ 1: Sục khí clo vào ống nghiệm chứa K2CO3 thu được hiện tượng là
A. Có khí không màu thoát ra.
B. Có khí màu nâu đỏ thoát ra.
C. Có kết tủa vàng.
D. Không có hiện tượng gì.
Hướng dẫn giải
K2CO3 + Cl2 → KCl + KClO + CO2
CO2: khí không màu,
Đáp án A.
Ví dụ 2: Thể tích khí CO2 ở dktc thoát ra khi cho 13,8g K2CO3 phản ứng hoàn toàn với lượng dư Cl2 là
A. 1,12 lít.
B. 2,24 lít.
C. 3,36 lít.
D. 4,48 lít.
Hướng dẫn giải
V = 0,1.22,4 = 2,24 lít.
Đáp án B.
Ví dụ 3: Thể tích khí Cl2 đktc cần dung để phản ứng hoàn toàn với K2CO3 thu được 0,1 mol CO2 la
A. 1,12 lít.
B. 2,24 lít.
C. 3,36 lít.
D. 4,48 lít.
Hướng dẫn giải
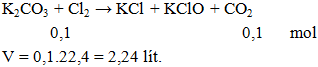
Đáp án B.
Xem thêm Một số phương trình phản ứng hóa học khác của Kali (K) & Hợp chất, chi tiết khác:
Bài viết cùng bài học: