Toptailieu.vn biên soạn và giới thiệu phương trình phản ứng Zn + O2 → ZnO | Zn ra ZnO. Đây là phản ứng oxi hóa khử, phản ứng hóa hợp đã được cân bằng chính xác và chi tiết nhất. Bài viết giới thiệu các nội dung liên quan giúp học sinh nắm bắt kiến thức cơ bản. Mời các bạn đón đọc:
Nội dung bài viết
1. Phương trình phản ứng hóa học:
2Zn + O2 → 2ZnO
2. Hiện tượng nhận biết phản ứng
Kẽm cháy sáng trong không khí tạo muối màu trắng.
3. Điều kiện phản ứng
- Nhiệt độ
4. Tính chất hoá học
a. Tính chất hoá học của Kẽm
- Kẽm là kim loại hoạt động có tính khử mạnh Zn → Zn2+ + 2e
Tác dụng với phi kim
- Zn tác dụng trực tiếp với nhiều phi kim.
2Zn + O2 → 2ZnO
Zn + Cl2 → ZnCl2
Tác dụng với axit
- Với các dung dịch axit HCl, H2SO4 loãng:
Zn + 2HCl → ZnCl2 + H2
- Với dung dịch HNO3, H2SO4 đặc:
Zn + 4HNO3 đ → Zn(NO3)2 + 2NO2 + 2H2O
Tác dụng với H2O
- Phản ứng này hầu như không xảy ra vì trên bề mặt của kẽm có màng oxit bảo vệ.
Tác dụng với bazơ
- Kẽm tác dụng với dung dịch bazơ mạnh: NaOH, KOH, Ca(OH)2....
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
b. Tính chất hoá học của O2
Khi tham gia phản ứng, nguyên tử O dễ dàng nhận thêm 2e. Nguyên tử oxi có độ âm điện lớn (3,44), chỉ kém flo (3,98).
Do vậy, oxi là nguyên tố phi kim hoạt động hoá học, có tính oxi hoá mạnh. Trong các hợp chất (trừ hợp chất với flo), nguyên tố oxi có số oxi hoá là -2.
Oxi tác dụng với hầu hết các kim loại (trừ Au, Pt, ...) và các phi kim (trừ halogen). Oxi tác dụng với nhiều hợp chất vô cơ và hữu cơ.
Tác dụng với kim loại
Tác dụng với hầu hết kim loại (trừ au và Pt), cần có to tạo oxit:
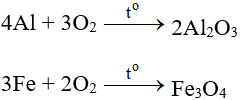
Tác dụng với phi kim
Tác dụng với hầu hết phi kim (trừ halogen), cần có to tạo oxit:
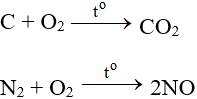
ĐB: Tác dụng với H2 nổ mạnh theo tỉ lệ 2:1 về số mol:
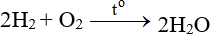
Tác dụng với hợp chất
- Tác dụng với các chất có tính khử:
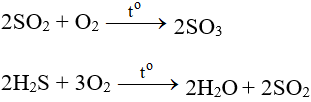
- Tác dụng với các chất hữu cơ:
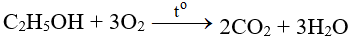
5. Cách thực hiện phản ứng
- Cho kẽm tác dụng với oxi
6. Bạn có biết
Kẽm là kim loại có tính khử mạnh nên dễ dàng tham gia phản ứng với các chất có tính oxi hóa mạnh như O2; Cl2 …
7. Bài tập liên quan
Ví dụ 1: Đốt cháy hoàn toàn m gam hỗn hợp gồm Mg và Zn cần vừa đủ 2,8 lít khí O2 (đktc), thu được 9,1 gam hỗn hợp 2 oxit. Giá trị của m:
A. 3,9 g
B. 6,7 g
C. 7,1 g
D. 5,1 g
Đáp án D
Hướng dẫn giải:
nO2 = 0,125 mol; ⇒ mO2 = 32.0,125 = 4 gam;
Ta có: mX + mO2 = m(oxit) ⇒ mX = 9,1 - 4 = 5,1 gam.
Ví dụ 2: Đốt cháy kim loại 3,25 g M trong oxi thu được oxit kim loại. Oxit kim loại tác dụng vừa đủ với 100ml dung dịch HCl 1 M. Kim loại M là:
A. Mg
B. Zn
C. Fe
D. Al
Đáp án B
Hướng dẫn giải:
Phương trình phản ứng: M + O2 → M2On
M2On + 2nHCl → 2MCln + nH2O
M = 3,25/(0,1/n) = 32,5 n ⇒ M là Zn
Ví dụ 3: Trong số các kim loại Al, Zn, Fe, Ag. Kim loại nào không tác dụng được với O2 ở nhiệt độ thường
A. Ag
B. Zn
C. Al
D. Fe
Đáp án A.
Xem thêm Một số phương trình phản ứng hóa học khác của Kẽm (Zn), chi tiết khác:
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.