Toptailieu.vn biên soạn và giới thiệu phương trình phản ứng Fe + HNO3 → Fe(NO3)3 + NH4NO3 + H2O | Fe ra Fe(NO3)3. Đây là phản ứng oxi hóa khử, phản ứng hóa hợp đã được cân bằng chính xác và chi tiết nhất. Bài viết giới thiệu các nội dung liên quan giúp học sinh nắm bắt kiến thức cơ bản. Mời các bạn đón đọc:
Nội dung bài viết
1. Phương trình phản ứng hóa học:
8Fe + 30HNO3 → 8Fe(NO3)3 + 3NH4NO3 + 9H2O
2. Hiện tượng nhận biết phản ứng
Kim loại tan dần tạo thành dung dịch màu vàng nâu không thấy có khí thoát ra.
3. Điều kiện phản ứng
- Dung dịch HNO3 đặc nóng.
4. Tính chất hoá học
4.1. Tính chất hoá học của Sắt
- Sắt là kim loại có tính khử trung bình, tùy theo các chất oxi hóa mà sắt có thể bị oxi hóa lên mức +2 hay +3.
Fe → Fe2+ + 2e
Fe → Fe3+ + 3e
Tác dụng với phi kim
a. Tác dụng với lưu huỳnh
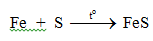
b. Tác dụng với oxi
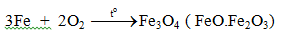
c. Tác dụng với clo
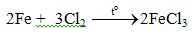
Tác dụng với axit
a.Tác dụng với dung dịch axit HCl, H2SO4 loãng
Fe + 2H+ → Fe2+ + H2
b. Với các axit HNO3, H2SO4 đặc
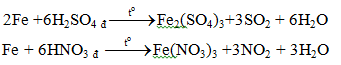
Fe + 4HNO3 l → Fe(NO3)3 + NO + 2H2O
Chú ý: Với HNO3 đặc, nguội; H2SO4 đặc, nguội: Fe bị thụ động hóa.
Tác dụng với dung dịch muối
- Fe đẩy được kim loại đứng sau ra khỏi dung dịch muối của chúng:
Fe+ CuSO4 → FeSO4 + Cu
Chú ý:
Fe + 2Ag+ → Fe2+ + 2Ag
Ag+ dư + Fe2+ → Fe3+ + Ag
4.2. Tính chất hoá học của HNO3
Tính axit
Là một trong số các axit mạnh nhất, trong dung dịch:
HNO3 → H+ + NO3-
- Dung dịch axit HNO3 có đầy đủ tính chất của môt dung dịch axit: làm đỏ quỳ tím, tác dụng với oxit bazơ, bazơ, muối của axit yếu hơn.
Tính oxi hóa
Kim loại hay phi kim khi gặp axit HNO3 đều bị oxi hóa về trạng thái oxi hóa cao nhất.
- Với kim loại: HNO3 oxi hóa hầu hết các kim loại (trừ vàng (Au) và platin(Pt))
* Với những kim loại có tính khử yếu: Cu, Ag, ...
Ví dụ:
Cu + 4HNO3(đ) → Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3(l) → 3Cu(NO3)2 + 2NO + 4H2O
* Khi tác dụng với những kim loại có tính khử mạnh hơn: Mg, Zn, Al, ...
- HNO3 đặc bị khử đến NO2.
Ví dụ:
Mg + 4HNO3(đ) → Mg(NO3)2 + 2NO2 + 2H2O.
- HNO3 loãng bị khử đến N2O hoặc N2.
8Al + 30HNO3(l) → 8Al(NO3)3 + 3N2O + 15H2O
- HNO3 rất loãng bị khử đến NH3(NH4NO3).
4Zn + 10HNO3 (rất loãng) → 4Zn(NO3)2 + NH4NO3 + 3H2O
* Lưu ý: Fe, Al, Cr bị thụ động hóa trong dung dịch HNO3 đặc nguội.
- Với phi kim:
Khi đun nóng HNO3 đặc có thể tác dụng với phi: C, P, S, …(trừ N2 và halogen).
S + 6HNO3(đ) → H2SO4 + 6NO2 + 2H2O
- Với hợp chất:
- H2S, HI, SO2, FeO, muối sắt (II), … có thể tác dụng với HNO3 nguyên tố bị oxi hoá trong hợp chất chuyển lên mức oxi hoá cao hơn.
Ví dụ:
3FeO + 10HNO3(đ) → 3Fe(NO3)3 + NO + 5H2O
3H2S + 2HNO3(đ) → 3S + 2NO + 4H2O
- Nhiều hợp chất hữu cơ như giấy, vải, dầu thông, … bốc cháy khi tiếp xúc với HNO3 đặc.
5. Cách thực hiện phản ứng
Cho kim loại sắt tác dụng với dung dịch axit nitric loãng dư
6. Bạn có biết
Fe tác dụng với axit HNO3 có thể tạo ra sản phẩm khử là khí NO2; NH4NO3; NO;… Trong đó chỉ có sản phẩm khử là muối amoni ở dạng dung dịch không phải dạng khí.
7. Bài tập liên quan
Ví dụ 1: Cho sắt tác dụng với axit HNO3 loãng thu được dung dịch màu vàng nâu và không thấy có khí thoát ra. Phương trình hóa học thể hiện đúng thí nghiệm trên là:
A. 8Fe + 30HNO3 → 8Fe(NO3)3 + 3NH4NO3 + 9H2O
B. Fe + 6HNO3 → Fe(NO3)3 + 3NO2 + 3H2O
C. Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
D. 10Fe + 36HNO3 → 10Fe(NO3)3 + 3N2 + 18H2O
Hướng dẫn giải
Đáp án A
Sản phẩm khử của HNO3 là dung dịch muối amoni NH4NO3
Ví dụ 2: Cho 1,12 g sắt tác dụng với dụng axit HNO3 loãng thu được dung dịch màu vàng nâu và không thấy có khí thoát ra. Khối lượng muối thu được là
A. 4,84 g
B. 2,42 g
C. 5,44 g
D. 3,02 g
Hướng dẫn giải
Đáp án C
nFe = 0,02 mol ⇒ nFe(NO3)3 = 0,02 mol; nNH4NO3 = 0,075 mol
mmuối = mFe(NO3)3 + mNH4NO3 = 0,02.242 + 0,075.80 = 5,44 g
Ví dụ 3: Cho sắt tác dụng axit HNO3 loãng dư. Sản phẩm khử của HNO3 có thể là:
A.NH4NO3
B. NO
C. N2O
D. Cả A, B, C
Hướng dẫn giải
Đáp số D
Xem thêm Một số phương trình phản ứng hóa học khác của Sắt (Fe) & Hợp chất, chi tiết khác:
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.