Toptailieu.vn biên soạn và giới thiệu phương trình phản ứng Au + Br2 → AuBr + AuBr3 | Au ra AuBr Đây là phản ứng oxi hóa khử đã được cân bằng chính xác và chi tiết nhất. Bài viết giới thiệu các nội dung liên quan giúp học sinh nắm bắt kiến thức cơ bản. Mời các bạn đón đọc:
1. Phương trình phản ứng hóa học:
2Au + 2Br2 → AuBr + AuBr3
2. Hiện tượng nhận biết phản ứng
- Xuất hiện chất rắn kết tinh màu đỏ sẫm
3. Điều kiện phản ứng
- Nhiệt độ từ 20 - 35°C
4. Tính chất hoá học
a. Tính chất hoá học cảu Vàng
- Vàng là kim loại quý có tính khử rất yếu
- Vàng không bị oxi hóa trong không khí dù ở nhiệt độ nào và không bị hòa tan trong axit, kể cả HNO3 nhưng vàng bị hòa tan trong một số trường hợp sau:
Nước cường toan (hỗn hợp 1 thể tích HNO3 và 3 thể tích HCl đặc).
Au + HNO3 (đặc) + 4HCl (đặc) → H[AuCl4] + NO + 2H2O
Dung dịch muối xianua của kim loại kiềm, như NaCN, tạo thành ion phức [Au(CN)2]-.
4Au + 8NaCN (đặc) + O2 + H2O → 4Na[Au(CN)2] + 4NaOH
- Thủy ngân, vì tạo thành hỗn hốn với Au (chất rắn, màu trắng). đốt nóng hỗn hống, thủy ngân bay hơi còn lại vàng.
b. Tính chất hoá học của Br2
Tác dụng với kim loại
Sản phẩm tạo muối tương ứng
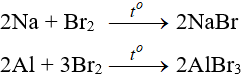
Tác dụng với hidro
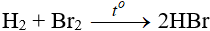
Độ hoạt động giảm dần từ Cl → Br → I
Các khí HBr, HI tan vào nước tạo dung dịch axit.
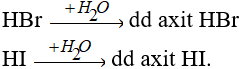
Về độ mạnh axit thì lại tăng dần từ HCl < HBr < HI.
Tính khử của Br2, HBr
- Brom thể hiện tính khử khi gặp chất oxi hóa mạnh (như nước clo, …)
Br2 + 5Cl2 + 6H2O → 2HBrO3 (Axit bromic) + 10HCl
- Tính khử của HBr (ở trạng thái khí cũng như trong dd) mạnh hơn HCl. HBr khử được H2SO4 đặc thành SO2.
2HBr + H2SO4đ → Br2 + SO2 + 2H2O
- Dd HBr không màu, để lâu trong không khí trở nên có màu vàng nâu vì bị oxi hóa (dd HF và HCl không có phản ứng này):
4HBr + O2 → 2H2O + 2Br2
5. Cách thực hiện phản ứng
- Cho kim loại vàng tác dụng với dung dịch brom dư
6. Bạn có biết
- Vàng là kim loại có tính khử yếu nên chỉ tác dụng với các chất oxi hóa mạnh như Cl2, F2 , Br2… khi ở nhiệt độ cao
7. Bài tập liên quan
Ví dụ 1: Điều kiện để phản ứng xảy ra khi cho vàng tác dụng với dung dịch brom là
A. xúc tác
B. nhiệt độ
C. áp suất
D. Cả A, B, C
Đáp án B
Ví dụ 2: Kim loại nào tác dụng với dung dịch brom dư tạo ra chất rắn kết tinh màu đỏ sẫm ?
A. Cu
B. Ag
C. Al
D. Au
Đáp án D
Ví dụ 3: Cho 3,94 g kim loại vàng tác dụng với dung dịch brom dư thì thu được m g muối . Giá trị của m là :
A. 6,64 g
B. 13,28 g
C. 19,92 g
D. 26,56 g
Đáp án C
Hướng dẫn giải:
2Au + 2Br2 → AuBr + AuBr3
Ta có : nAu = 3,94/197 = 0,02 mol ;
Theo pt : nAuBr = nAuBr3 = nAu = 0,02 mol
⇒ mmuối = 0,02.227 + 0,02.437 = 13,28 g
Xem thêm Một số phương trình phản ứng hóa học khác của Vàng (Au) chi tiết khác:
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.