Toptailieu.vn biên soạn và giới thiệu phương trình phản ứng 2K + S → 2K2S | K ra K2S | S ra K2S. Phản ứng 2K + S → 2K2S | K ra K2S | S ra K2S thuộc loại phản ứng oxi hóa khử, phản ứng hóa hợp đã được cân bằng chính xác và chi tiết nhất. Bài viết giới thiệu các nội dung liên quan giúp học sinh nắm bắt kiến thức cơ bản.. Mời các bạn đón đọc:
1. Phương trình phản ứng hóa học:
2K + S → K2S
2. Hiện tượng nhận biết phản ứng
K phản ứng với lưu huỳnh đun nóng tỏa nhiều nhiệt tạo chất rắn màu trắng.
3. Điều kiện phản ứng
- Nhiệt độ
4. Tính chất hóa học
- Kali là kim loại kiềm có tính khử rất mạnh.
K → K+ + 1e
a. Tác dụng với phi kim
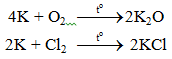
b. Tác dụng với axit
2K + 2HCl → 2KCl + H2.
c. Tác dụng với nước
- K tác dụng mãnh liệt với nước và tự bùng cháy tạo thành dung dịch kiềm và giải phóng khí hidro.
2K + 2H2O → 2KOH + H2.
d. Tác dụng với hidro
- Kali tác dụng với hidro ở áp suất khá lớn và nhiệt độ khoảng 350 – 400oC tạo thành kali hidrua.
2K (lỏng) + H2 (khí) → 2KH (rắn)
5. Cách thực hiện phản ứng
- Cho kali tác dụng với lưu huỳnh thu được kalisunfua.
6. Bạn có biết
K tham gia phản ứng mãnh liệt với các phi kim.
Ví dụ 1: Kim loại kali tác dụng với bao nhiêu chất sau: HCl, O2, Cl2, S, KOH?
A. 1
B. 2
C. 3
D.4
Đáp án D
Hướng dẫn giải:
Phương trình hóa học:
4K + O2 → 2K2O;
2K + Cl2 → 2KCl;
2K + S → K2S;
2K + 2HCl → 2KCl + H2
Ví dụ 2: Muối kalisunfua thu được khi cho kali tác dụng với S có tính chất gì?
A. Tan trong nước tạo thành dung dịch có pH = 7
B. Tan trong nước tạo thành dung dịch có pH > 7
C. Tan trong nước tạo thành dung dịch có pH < 7
D. Không tan trong nước
Đáp án B
Hướng dẫn giải:
K2S → 2K+ + S2-; S2- + H2O → HS- + OH-
Ví dụ 3: Cho 3,9 g K tác dụng với 1,6 g phi kim X thu được muối của K2X. X là
A. Cl2
B. Br2
C. S
D. O2
Đáp án C
Hướng dẫn giải:
Phương trình phản ứng: 2K + S → K2S
nX = nK/2 = 0,05 mol ⇒ MX = 1,6/0,05 = 32 g ⇒ X là S
Xem thêm Một số phương trình phản ứng hóa học khác của Kali (K) & Hợp chất, chi tiết khác:
Bài viết cùng bài học:




