Toptailieu.vn biên soạn và giới thiệu phương trình phản ứng Cr + Cl2 → CrCl3 | Cr ra CrCl3. Đây là phản ứng oxi hóa khử, phản ứng hóa hợp đã được cân bằng chính xác và chi tiết nhất. Bài viết giới thiệu các nội dung liên quan giúp học sinh nắm bắt kiến thức cơ bản. Mời các bạn đón đọc
Nội dung bài viết
1. Phương trình phản ứng hóa học:
2Cr + 3Cl2 → 2CrCl3
2. Hiện tượng nhận biết phản ứng
- Crom cháy sáng trong bình khí clo.
3. Điều kiện phản ứng
- Nhiệt độ cao.
4. Tính chất hoá học
4.1. Tính chất hoá học của Crom
- Là kim loại có tính khử mạnh hơn sắt.
- Trong các hợp chất crom có số oxi hoá từ +1 → +6 (hay gặp +2, +3 và +6).
Tác dụng với phi kim
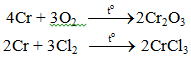
Tác dụng với nước
Cr bền với nước và không khí do có lớp màng oxit rất mỏng, bền bảo vệ. Người ta mạ crom lên sắt để bảo vệ sắt và dùng Cr để chế tạo thép không gỉ.
Tác dụng với axit
Cr + 2HCl → CrCl2 + H2
Cr + H2SO4 → CrSO4 + H2
Cr không tác dụng với dung dịch HNO3 hoặc H2SO4 đặc, nguội.
4.2. Tính chất hoá học của Cl2
Tác dụng với kim loại
Đa số kim loại và có to để khơi màu phản ứng tạo muối clorua (có hoá trị cao nhất )
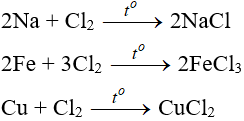
Tác dụng với phi kim
(cần có nhiệt độ hoặc có ánh sáng)
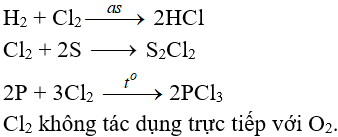
Tác dụng với nước và dung dịch kiềm
Cl2 tham gia phản ứng với vai trò vừa là chất ôxi hóa, vừa là chất khử.
Tác dụng với nuớc
Khi hoà tan vào nước, một phần Clo tác dụng (Thuận nghịch)
Cl20 + H2O → HCl + HClO (Axit hipoclorơ)
Axit hipoclorơ có tính oxy hoá mạnh, nó phá hửy các màu vì thế nước clo hay clo ẩm có tính tẩy màu do.
Tác dụng với muối của các halogen khác
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2FeCl2 → 2FeCl3
3Cl2 + 6FeSO4 → 2Fe2(SO4)3 + 2FeCl3
Cl2 + 2KI → 2KCl + I2
Tác dụng với chất khử khác
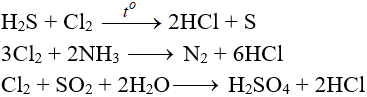
Phản ứng thế, phản ứng cộng, phản ứng phân huỷ với một số hợp chất hữu cơ
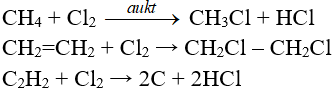 Tác dụng với dung dịch bazơ
Tác dụng với dung dịch bazơ
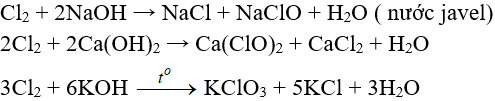
5. Cách thực hiện phản ứng
- Đốt crom sau đó cho kim loại crom vào bình khí clo.
6. Bạn có biết
- Ở nhiệt độ cao crom cũng khử được nhiều phi kim.
7. Bài tập liên quan
Ví dụ 1: Phản ứng nào sau đây là sai?
A. Cr(OH)3 + NaOH → NaCrO2 + 2H2O
B. 3Zn + 2CrCl3 → 3ZnCl2 + 2Cr
C. 2Cr + 3Cl2 → 2CrCl3
D. 2Na2CrO4 + H2SO4 → Na2Cr2O7 + Na2SO4 + H2O
Hướng dẫn giải
Đáp án B
PT phản ứng : Zn + 2CrCl3 → ZnCl2 + 2CrCl2.
Ví dụ 2: Khi cho crom tác dụng với clo sẽ tạo ra dung dịch màu gì?
A. màu tím
B. vàng cam
C. màu xanh.
D. lục sẫm.
Hướng dẫn giải
Đáp án A
2Cr + 3Cl2 → 2CrCl3
Khi cho crom tác dụng với clo sẽ tạo ra dung dịch màu màu tím.
Ví dụ 3: Cho 7.8 gam kim loại Cr tác dụng vừa đủ với V(lít) Cl2 ở đktc. Giá trị của V là
A. 3.36 (l)
B. 4.48 (l)
C. 5.04 (l)
D. 10.08(l)
Hướng dẫn giải
Đáp án C
nCr = 0.15 mol
2Cr + 3Cl2 → 2CrCl3
0.15 0.225 mol
V Cl2 = 0.225 x 22.4 = 5.04 (l)
Xem thêm Một số phương trình phản ứng hóa học khác của Crom (Cr) & Hợp chất, chi tiết khác:
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.