Toptailieu.vn biên soạn và giới thiệu phương trình phản ứng Al + S → Al2S3 | Al ra Al2S3. Đây là phản ứng oxi hóa khử, phản ứng hóa hợp đã được cân bằng chính xác và chi tiết nhất. Bài viết giới thiệu các nội dung liên quan giúp học sinh nắm bắt kiến thức cơ bản. Mời các bạn đón đọc:
1. Phương trình phản ứng hoá học
2Al + 3S → Al2S3
2. Hiện tượng nhận biết phản ứng
Al màu trắng bạc tác dung với S màu vàng tạo muối màu trắng Al2S3.
3. Điều kiện phản ứng
- Nhiệt độ cao (150 – 2000C)
4. Tính chất hoá học
Nhôm là kim loại có tính khử mạnh: Al → Al3+ + 3e
Tác dụng với phi kim
a) Tác dụng với oxi
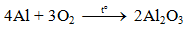
Al bền trong không khí ở nhiệt độ thường do có lớp màng oxit Al2O3 rất mỏng bảo vệ.
b) Tác dụng với phi kim khác
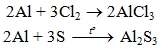
Tác dụng với axit
+ Axit không có tính oxi hóa: dung dịch axit HCl, H2SO4 loãng
2Al + 6HCl → 2AlCl3 + 3H2↑
+ Axit có tính oxi hóa mạnh: dung dịch HNO3 loãng, HNO3 đặc, nóng và H2SO4 đặc, nóng.
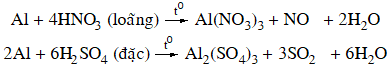
Nhôm bị thụ động hoá trong dung dịch HNO3 đặc, nguội hoặc H2SO4 đặc nguội.
Tác dụng với oxit kim loại( Phản ứng nhiệt nhôm)
Lưu ý: Nhôm chỉ khử oxit của các kim loại đứng sau nhôm
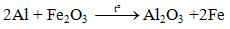
Tác dụng với nước
- Phá bỏ lớp oxit trên bề mặt Al (hoặc tạo thành hỗn hống Al-Hg thì Al sẽ phản ứng với nước ở nhiệt độ thường)
2Al + 6H2O → 2Al(OH)3↓ + 3H2↑
Tác dụng với dung dịch kiềm
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
Tác dụng với dung dịch muối
- Al đẩy được kim loại đứng sau ra khỏi dung dịch muối của chúng:
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
5. Cách thực hiện phản ứng
- Cho Al tác dụng với S.
6. Bạn có biết
Tương tự Al, các kim loại khác (trừ Pt, Au) có phản ứng với S tạo muối sunfua
7. Bài tập liên quan
Ví dụ 1: Phương trình phản ứng nào sau đây đúng?
A. Na + S ![]() NaS2
NaS2
B. Cu + 2S → Cu2S
C. 4K + O2 → 2K2O
D. 2Al + 3S 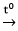 Al2S3
Al2S3
Hướng dẫn giải
Chọn D.
A. 2Na + S 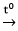 Na2S
Na2S
B. 2Cu + S 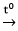 Cu2S
Cu2S
C. 4K + O2 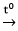 2K2O
2K2O
Ví dụ 2: Tính khối lượng Al tác dụng vừa đủ với 3,2 gam S để tạo thành muối Al2S3?
A. 0,9 gam.
B. 1,8 gam.
C. 2,7 gam.
D. 4,5 gam.
Hướng dẫn giải
Chọn B.
2Al + 3S 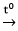 Al2S3
Al2S3
nS=![]() =0,1 mol ⇒ nAl=
=0,1 mol ⇒ nAl=![]() nS=
nS=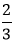
![]() mol
mol
Vậy mAl=![]() .27=1,8 gam.
.27=1,8 gam.
Ví dụ 3:Muối Al2S3 tạo thành từ phản ứng 2Al + 3S ![]() Al2S3 có màu gì?
Al2S3 có màu gì?
A. Màu đen.
B. Màu trắng.
C. Màu đỏ.
D. Màu vàng.
Hướng dẫn giải
Chọn B.
Xem thêm Một số phương trình phản ứng hóa học khác của Nhôm (Al), chi tiết khác:
Bài viết cùng bài học:




