Toptailieu.vn biên soạn và giới thiệu phương trình phản ứng 4Mg + 10HNO3 → 4Mg(NO3)2 + N2O + 5H2O | Mg ra Mg(NO3)2. Phản ứng 4Mg + 10HNO3 → 4Mg(NO3)2 + N2O + 5H2O | Mg ra Mg(NO3)2 thuộc loại phản ứng oxi hóa khử đã được cân bằng chính xác và chi tiết nhất. Bài viết giới thiệu các nội dung liên quan giúp học sinh nắm bắt kiến thức cơ bản. Mời các bạn đón đọc:
1. Phương trình phản ứng hóa học:
4Mg + 10HNO3 → 4Mg(NO3)2 + N2O + 5H2O
2. Phương trình ion thu gọn Mg + HNO3
Phương trình phân tử:
4Mg + 10HNO3 → 4Mg(NO3)2 + N2O + 5H2O
Phương trình ion thu gọn:
4Mg + 10H+ + 2NO3- → 4Mg2+ + N2O + 5H2O
3. Hiện tượng nhận biết phản ứng
Kim loại tan dần tạo thành dung dịch không màu và khí không màu thoát ra.
4. Điều kiện phản ứng
Dung dịch HNO3 loãng dư.
5. Tính chất hóa học
5.1. Tính chất hóa học của Mg
- Magie là chất khử mạnh:
Mg → Mg2+ + 2e
a. Tác dụng với phi kim
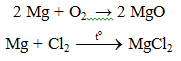
Lưu ý:
- Do Mg có ái lực lớn với oxi: 2Mg + CO2 → MgO. Vì vậy không dùng tuyết cacbonic để dập tắt đám cháy Mg.
b. Tác dụng với axit
- Với dung dịch HCl và H2SO4 loãng:
Mg + H2SO4 → MgSO4 + H2
- Với dung dịch HNO3:
4Mg + 10 HNO3 → 4 Mg(NO3)2 + NH4NO3 + 3 H2O
5.2. Tính chất hóa học của HNO3 (Axit nitric)
Axit nitric được xếp hạng trong danh sách những axit mạnh nhất. Đây là một axit khan – một monoaxit mạnh có thể nitrat hóa nhiều hợp chất vô cơ với hằng số cân bằng axit (pKa) = -2.
Axit nitric phân li hoàn toàn thành các ion H+ và NO3- trong dung dịch loãng. Dung dịch HNO3 làm quỳ tím chuyển đỏ.
HNO3 có tác dụng với oxit bazơ, bazơ và muối của axit yếu hơn tạo ra muối nitrat.
Ví dụ:
CuO + 2HNO3 → Cu(NO3)2 + H2O
CaCO3 + 2HNO3 → Ca(NO3)2 + H2O + CO2
Ba(OH)2 + 2HNO3 → Ba(NO3)2 + 2H2O
Axit nitric tác dụng với oxit bazơ, bazo, muối mà kim loại trong hợp chất này chưa lên hóa trị cao nhất:
Ví dụ:
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
FeCO3 + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
Axit nitric cũng là 1 trong những axit có tính oxi hóa mạnh. Nó có thể bị khử đến các sản phẩm khác nhau của nitơ, phụ thuộc vào nồng độ axit mạnh hay yếu của chất khử. Cùng tìm hiểu tính oxi hóa của axit nitric thông qua 3 phản ứng:
Một là,Tác dụng với kim loại
Hai là, Tác dụng với phi kim
Ba là, Tác dụng với hợp chất
Tác dụng với kim loại
Axit nitric có khả năng oxi hóa hầu hết các kim loại tạo ra muối nitrat, ngay cả kim loại có tính khử yếu (Cu, Ag)…, ngoại trừ Pt và Au. Lúc này, kim loại bị oxi hóa đến mức cao nhất. Sản phẩm của phản ứng này sẽ là NO2(+4) đối với HNO3 đặc và NO(+2) đối với HNO3 loãng. Nhôm, sắt và crom thụ động với axit nitric đặc nguội vì lớp màng oxit bền được tạo ra bảo vệ chúng không bị oxy hóa tiếp. Đây cũng là lý do bình nhôm hoặc sắt được dùng để đựng HNO3 đặc.
Phương trình phản ứng:
Kim loại + HNO3 đặc → muối nitrat + NO + H2O (nhiệt độ)
Kim loại + HNO3 loãng → muối nitrat + NO + H2O
Kim loại + HNO3 loãng lạnh → muối nitrat + H2
Mg(rắn) + 2HNO3 loãng lạnh → Mg(NO3)2 + H2 (khí)
Ví dụ:
Cu + 4HNO3 đặc → Cu(NO3)2 + 2NO2(↑) + 2H2O
3Cu + 8HNO3 loãng → 3Cu(NO3)2 + 2NO (↑) + 4H2O
Tác dụng với phi kim
Khi được đun nóng, HNO3 đặc có khả năng oxi hóa được các phi kim như S, C, P… (các nguyên tố á kim, ngoại trừ halogen và silic). Sản phẩm tạo thành là nito dioxit (nếu là axit nitric đặc) và oxit nito (với axit loãng và nước).
Ví dụ:
S + 6HNO3 đặc → H2SO4 + 6NO2(↑) + 2H2O (nhiệt độ)
C + 4HNO3 đặc → 4NO2 + 2H2O + CO2
P + 5HNO3 đặc → 5NO2 + H2O + H3PO4
3C + 4HNO3 loãng → 3CO2 + 4NO + 2H2O
Tác dụng với hợp chất
Là một trong những axit cực mạnh, axit nitric (HNO3) đặc có khả năng oxi hóa – phá hủy nhiều hợp chất vô cơ, hữu cơ khác nhau.. Vải, giấy, mùn cưa,… đều bị phá hủy hoặc bốc cháy khi tiếp xúc với HNO3 đặc. Vì vậy, sẽ vô cùng nguy hiểm nếu để axit nitric (HNO3) tiếp xúc với cơ thể người.
Ví dụ:
3H2S + 2HNO3 (>5%) → 3S (↓) + 2NO + 4H2O
PbS + 8HNO3 đặc → PbSO4(↓) + 8NO2 + 4H2O
HNO3 hòa tan Ag3PO4, không tác dụng với HgS
6. Cách thực hiện phản ứng
Cho kim loại magie tác dụng với dung dịch axit nitric
7. Bạn có biết
Mg tác dụng với axit HNO3 có thể tạo ra sản phẩm khử là khí NO2; NH4NO3; NO;… Trong đó chỉ có sản phẩm khử là muối amoni ở dạng dung dịch không phải dạng khí.
8. Bài tập liên quan
Ví dụ 1: Hòa tan hoàn toàn 25,3 gam hỗn hợp X gồm Mg, Al và Zn bằng dung dịch HNO3. Sau khi phản ứng kết thúc thu được dung dịch Y và 4,48 lít (đkc) khí N2O (sản phẩm khử duy nhất). Cô cạn dung dịch Y thu được m gam hỗn hợp muối. Giá trị của m là:
A. 26,5 g
B. 27,78 g
C. 32,5 g
D 28,6 g
Hướng dẫn giải:
Đáp án B
Ta có nNO3-tạomuối = 8nN2O = 0,02.2 = 0,04 mol
mmuối = mKL + mNO3-tạomuối = 25,3 + 0,04.62 = 27,78 g
Ví dụ 2: Cho 2,4 g Mg tác dụng với dụng với HNO3 dư thu được V lít khí N2O sản phẩm khử duy nhất. Giá trị của V là:
A. 2,24 lít
B. 0,56 lít
C. 1,12 lít
D. 0,336 lít
Hướng dẫn giải:
Đáp án B
4Mg + 10HNO3 → 4Mg(NO3)2 + N2O + 5H2O
nN2O = .nMg /4 = 0,1/4 = 0,025 mol ⇒ V = 0,56 lít
Ví dụ 3: Cho phản ứng hoa học sau: Mg + HNO3→ Mg(NO3)2 + N2O + H2O
Tổng hệ số cân bằng của phản ứng trên là:
A. 24
B. 18
C. 12
D. 16
Hướng dẫn giải:
Đáp án A
4Mg + 10HNO3 → 4Mg(NO3)2 + N2O + 5H2O
Ví dụ 4: Tiến hành thí nghiệm sau: thả một mẩu natri vào dung dịch chứa MgSO4.
Hiện tượng xảy ra được dự đoán như sau :
(a) Mẩu natri chìm xuống đáy dung dịch
(b) Kim loại magie màu trắng bạc thoát ra, lắng xuống đáy ống nghiệm.
(c) Dung dịch vẫn trong suốt.
(d) Có khí thoát ra.
Trọng các hiện tượng trên, số hiện tượng xảy ra đúng như dự đoán là
A. 1.
B. 2.
C. 3.
D.4.
Hướng dẫn giải:
Đáp án A
Hiện tượng phản ứng xảy ra: Mẩu Na tan dần, có khí thoát ra, xuất hiện kết tủa trắng.
Phương trình hóa học
2Na + 2H2O → 2NaOH + H2↑
MgSO4 + 2NaOH → Mg(OH)2 (↓trắng) + Na2SO4
Ví dụ 5: Tiến hành đồng thời 3 thí nghiệm sau với cùng một khối lượng bột nhôm như nhau :
Thi nghiệm 1: Cho bột nhôm vào dung dịch HCl dư thu được V1 lít khí không màu.
Thí nghiệm 2: Cho bột nhôm vào dung dịch NaOH dư thu được V2 lít khí không màu.
Thí nghiệm 3: Cho bột nhôm vào dung dịch HNO3 loãng dư thu được khí V3 lít khí không màu và hoá nâu trong không khí.
Các thểtích V1, V2 và V3 đo ở cùng điều kiện.
Mối quan hệ giữa V1, V2 và V3 nào sau đây là đúng ?
A. V1 = V2 = V3
B. V1 > V2 > V3
C. V1 < V2 < V3
D. V1 = V2 > V3
Hướng dẫn giải:
Đáp án D
Gọi số mol của al ở mỗi thí nghiệm là x mol
Ta có:
Thí nghiệm 1: Áp dụng bào toàn electron
3.nAl = 2nH2
Thí nghiệm 2: Áp dụng bào toàn electron
3.nAl = 2nH2
=> nH2 = 1,5x mol
Thí nghiệm 3: Áp dụng bào toàn electron
nAl = nNO = x mol
=> V1 = V2 > V3
Ví dụ 6: Cho hỗn hợp các chất sau: Na, Na2O, Fe, Al hòa tan vào nước, các chất tan được trong nước là:
A. Na, Na2O
B. Na, Al
C. Na, Al, Na2O
D. Na2O, Al
Hướng dẫn giải:
Đáp án A
Phương trình phản ứng minh họa
2Na + 2H2O → 2NaOH + H2↑
Na2O + H2O → 2NaOH
Ví dụ 7: Dung dịch các chất không làm đổi màu quỳ tím là:
A. Na2CO3
B. NaHCO3
C. CH3COOH
D. C6H5OH
Hướng dẫn giải:
Đáp án A
Ví dụ 8: Chọn câu đúng nhất trong số các câu sau đây;
A. NaHCO3 tan trong nước tạo dung dịch có pH < 7
B. NaHCO3 kém bền có tính axit
C. NaHCO3 kém bền, có tính lưỡng tính
D. NaHCO3 tác dụng với CaCl2 tạo kết tủa trắng
Hướng dẫn giải:
Đáp án D
Phương trình phản ứng minh họa
2NaHCO3 + CaCl2 ⟶ CaCO3 + H2O + 2NaCl + CO2
Ví dụ 9: Hỗn hợp X chứa K2O, NH4Cl, KHCO3 và BaCl2 có số mol mỗi chất đều bằng nhau. Cho hỗn hợp X vào H2O dư, đun nóng thu được dung dịch chứa:
A. KCl, KHCO3, NH4Cl, BaCl2.
B. KCl, KOH, BaCl2.
C. KCl.
D. KCl, KOH.
Hướng dẫn giải:
Đáp án C
K2O thả vào nước tạo ra KOH, các chất sẽ phản ứng với nhau tạo ra khí amoniac, BaCO3 kết tủa... chỉ còn lại KCl.
Ví dụ 10:Cho các chất sau: Ca(OH)2, KOH, BaCO3, Ba(HCO3)2, KNO3, Mg(OH)2.
Số chất bị nhiệt phân có chất khí trong sản phẩm tạo thành là:
A. 5
B .4
C. 3
D. 2
Hướng dẫn giải:
Đáp án C
Có ba chất khi bị nhiệt phân sinh ra chất khí là: BaCO3; Ba(HCO3)2; KNO3
BaCO3 BaO + CO2
Ba(HCO3)2 BaCO3 + CO2 + H2O
KNO3 KNO2 + O2
Ví dụ 11: Cho 1,08 gam Mg tác dụng với dung dịch HNO3 (dư). Sau khi phản ứng xảy ra hoàn toàn thu được 0,448 lít khí NO (ở đktc) và dung dịch M. Khối lượng muối khan thu được khi làm bay hơi dung dịch M là
A. 13,32 gam.
B. 6,96 gam.
C. 8,88 gam.
D. 13,92 gam.
Hướng dẫn giải:
Đáp án B
Theo đầu bài ta có
nMg = 0,045 mol ; nNO = 0,02 mol
Bảo toàn e:
2nMg = 3nNO + 8nNH4NO3 nếu có
=> nNH4NO3 = 0,00375 mol
=> Chất rắn gồm: 0,00375 mol NH4NO3 ; 0,045 mol Mg(NO3)2
=> mmuối khan = mNH4NO3 + mMg(NO3)2 = 6,96 gam
Ví dụ 12: Cho Ag vào 100ml dung dịch Mg(NO3)2 0,5M. Thêm tiếp vào hổn hợp 150 ml dung dịch H2SO4 2M. Khuấy dều và thêm nước vào đến dư cho phản ứng xảy ra hoàn toàn thấy Ag tan 1 phần và có khí bay ra. Thêm tiếp dung dịch NaBr đến dư vào dung dịch sau phản ứng thấy có kết tủa màu vàng. Khối lượng kết tủa vàng là:
A. 94 gam
B. 112,8 gam
C. 169,2 gam
D. 56,4 gam
Hướng dẫn giải:
Đáp án D
nNO3−= 2nMg(NO3)2 = 0,1 mol
nH+ = 2nH2SO4= 0,6 mol
4H+ + NO3-+ 3e → NO + H2O
0,6 0,1 → 0,3
Ag + 1e → Ag+
0,3 → 0,3
Ag+ + Br− → AgBr
0,3 → 0,3
mAgBr= 0,3.188 = 56,4 gam
Ví dụ 13: Cho m gam Mg vào dung dịch chứa 0,06 mol FeCl3. Sau khi phản ứng xảy ra hoàn toàn thu được 1,68 gam chất rắn. Giá trị của m là
A. 4,32
B. 2,88
C. 2,16
D. 1,44
Hướng dẫn giải:
Đáp án D
Xét 2 trường hợp:
Trường hợp 1. Sau phản ứng Mg còn dư. Chỉ có phản ứng (1) khối lượng chất rắn thu được là Fe vào Mg dư
nFe = nFeCl3 = 0,06 mol => mFe= 0,06 . 56 = 3,36 gam > 1,68 (loại)
Trường hợp 2: Xảy ra 2 phản ứng (1) và (2) (khi Mg hết FeCl3 còn sẽ tác dụng tiếp với Fe)
3Mg + 2FeCl3 → 3MgCl2+ 2Fe (1)
a → 2a/3 → 2a/3
Fe + 2FeCl3 → 3FeCl2(2)
2a/3 - 0,03 --> 2(2a/3 - 0,03)
Gọi số mol Mg là: nMg = a mol
nFe dư sau pư 2 = 1,68 : 56 = 0,03 mol => nFe (pư2) = (2a/3 - 0,03) mol
Theo phản ứng (1, 2) ta có:
nFeCl3 = 2a/3 + 2(2a/3 - 0,03) = 0,06 mol
=> a = 0,06 mol
=> m = 0,06 . 24 = 1,44 gam
Ví dụ 14: Cho miếng Mg tác dụng với HNO3, sau phản ứng không thấy có khí sinh ra. Hệ số cân bằng của HNO3trong phản ứng là
A. 8
B. 9
C. 10
D. 12
Hướng dẫn giải:
Đáp án C
Phản ứng không sinh ra khí => sản phẩm khử là muối NH4NO3
4Mg + 10HNO3 → 4Mg(NO3)2+ NH4NO3+ 3H2O
Ví dụ 15: Có những nhận định sau về muối amoni:
1) Tất cả muối amoni đều tan trong nước
2) Các muối amoni đều là chất điện li mạnh, trong nước muối amoni điện li hoàn toàn tạo ra ion NH4+ không màu, tạo môi trường bazơ
3) Muối amoni đều phản ứng với dung dịch kiềm giải phóng khí amoniac
4) Muối amoni kém bền đối với nhiệt
Số nhận định đúng là
A. 2
B. 3
C. 4
D. 1
Hướng dẫn giải:
Đáp án B
1) Đúng
2) Sai vì NH4+ tạo môi trường axit
3) Đúng
4) Đúng
Ví dụ 16: Tiến hành các thí nghiệm sau:
(a) Cho Mg vào dung dịch Fe2(SO4)3dư
(b) Sục khí H2S vào dung dịch FeCl3
(c) Cho FeS tác dụng với dung dịch HCl
(d) Cho dung dịch AgNO3 vào dung dịch HCl
(e) Cho tinh thể NaNO2 vào dung dịch NH4Cl bão hòa rồi đun nóng
Số thí nghiệm không sinh ra đơn chất là
A. 4
B. 2
C. 3
D. 5
Hướng dẫn giải:
Đáp án B
(a) Mg + Fe2(SO4)3 → MgSO4 + FeSO4
(b) H2S + FeCl3 → FeCl2 +HCl + S↓
(c) FeS + 2HCl → FeCl2 + H2S
(d) AgNO3 + HCl → AgCl↓ + HNO3
(e) NaNO2+ NH4Cl → NaCl + N2↑ + 2H2O
Số thí nghiệm không sinh đơn chất là 2
Xem thêm Một số phương trình phản ứng hóa học khác của Magie (Mg) & Hợp chất, chi tiết khác:
CÔNG TY TNHH ĐẦU TƯ VÀ DỊCH VỤ GIÁO DỤC VIETJACK
- Người đại diện: Nguyễn Thanh Tuyền
- Số giấy chứng nhận đăng ký kinh doanh: 0108307822, ngày cấp: 04/06/2018, nơi cấp: Sở Kế hoạch và Đầu tư thành phố Hà Nội.
2021 © All Rights Reserved.